Larutan elektrolit dan larutan non elektrolit – Terdapat banyak sekali reaksi kimia yang terjadi di lingkungan berair. Sebagai contoh, reaksi dalam tubuh manusia dan lain sebagainya.
Dalam hal ini penting sekali untuk memahami konsep larutan. Larutan terbentuk dari zat pelarut dan zat terlarut. Dalam pembahasan ini, akan dijelaskan mengenai zat terlarut pada zat pelarut berupa air.
Berdasarkan kemampuannya dalam menghantarkan arus listrik, larutan dapat dibagi menjadi dua yaitu larutan elektrolit dan larutan non elektrolit. Untuk mengetahui sifat penghantar listrik ini dapat digunakan metode pengujian elektrolit. Metode ini dilakukan dengan serangkaian alat elektrode yang dihubungkan dengan sumber listrik dan lampu pijar.
Cara Pengujian Larutan Elektrolit dan Larutan Non Elektrolit
Untuk mengetahui apakah suatu larutan tergolong elektrolit atau bukan elektrolit, bisa digunakan rangkaian elektrode yang terbuat dari logam yang dapat menghantarkan arus listrik.
Kemudian elektrode tersebut dihubungkan ke sumber arus listrik seperti baterai dan lampu pijar. Dua elektrode dipasang terpisah dan dimasukkan ke dalam wadah atau tabung yang telah berisi larutan yang akan diuji.
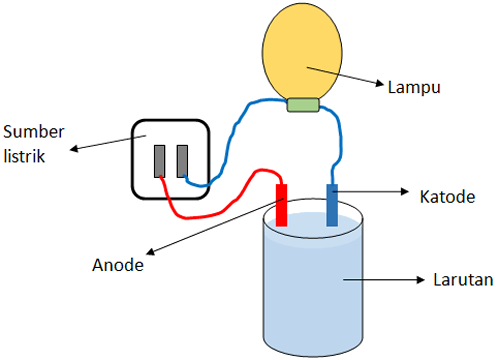
Kemudian proses pengamatan dilakukan. jika setelah elektrode dimasukkan ke dalam larutan lalu lampu pijar menyala maka larutan tersebut bersifat elektrolit.
Pengamatan lainnya yang akan didapat yaitu adanya gelembung udara di sekitar elektrode. Jika lampu tidak menyala dan tidak ada gelembung maka dapat dipastikan jika larutan termasuk non elektrolit.
Senyawa Ion dan Senyawa Kovalen
Tahukah kamu jika beberapa zat padat tidak dapat mengantarkan listrik namun ketika dalam fase cair atau dalam bentuk larutan, zat tersebut mampu menghantarkan arus listrik. Contoh zat padat tersebut adalah garam dapur. HCl juga akan mampu menghantarkan arus listrik apabila sudah dilarutkan ke dalam air.
Contoh lainnya misalnya air, air murni sebenarnya bisa menghantarkan listrik namun sangat buruk. Namun jika ke dalam air tersebut dimasukkan padatan garam dapur (NaCl), maka akan ditemukan gelembung udara dan lampu yang menyala pada pengujian elektrolit.
Selain itu juga ada zat padat yang meskipun telah dilarutkan ke dalam air tetap tidak bisa menghantarkan listrik. Sebagai contoh, gula pasir yang dilarutkan ke dalam air. Jika dilakukan uji elektrolit maka tidak akan menyalakan lampu. Inilah yang disebut dengan larutan non elektrolit.
Lalu pertanyaannya, mengapa garam yang padat tidak bisa menghantarkan arus listrik sedangkan garam dalam bentuk larutan bisa menghantarkan arus listrik? Arrhenius menjawab masalah ini bahwa yang bertugas menghantarkan listrik di dalam larutan adalah ion-ion. Ion tersebut bergerak bebas di dalam larutan. Sedangkan pada zat padat, ion-ion terikat satu sama lain sehingga tidak bisa bergerak bebas.
Untuk senyawa kovalen seperti HCl, ia tidak memiliki ion namun molekul HCl itu sendiri. HCl adalah jenis kovalen polar dimana memiliki kutub positif dan negatif karena terdapat beda keelektronegatifan.
Dalam air, molekul terurai menjadi ion positif dan negatif dan menghantarkan listrik. Ion positif akan menuju ke elektrode negatif sedangkan ion negatif akan bergerak ke elektrode positif.
Larutan Elektrolit Kuat dan Elektrolit Lemah
Berdasarkan uji elektrolit yang telah dibahas, kita bisa menemukan atau mengamati larutan mana yang merupakan elektrolit dan bukan elektrolit. Namun tidak hanya itu, kita juga bisa mengetahui larutan elektrolit kuat dan elektrolit lemah.
Elektrolit kuat dapat diketahui yaitu dengan melihatnya banyaknya gelembung yang ada di sekitar elektrode dan lampu yang menyala terang. Sedangkan untuk elektrolit lemah dapat diketahui jika gelembung yang dihasilkan sangat sedikit dan lampu menyala redup. Bahkan beberapa elektrolit lemah hanya menghasilkan gelembung namun tidak menyalakan lampu.
Nah, bila ada pertanyaan terkait larutan elektrolit dan non elektrolit bisa disampaikan di bawah ini. Untuk penjelasan lebih detailnya akan kita bahas pada halaman lain.
Baca juga: Kemolalan, Kemolaran dan Fraksi Mol
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.