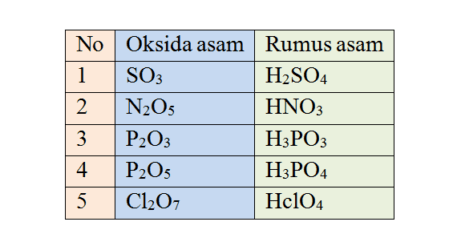
Teori Asam Basa dan Garam – Istilah asam dan basa sudah dikenal sejak zaman dahulu kala, asam (acid) berasal dari bahasa latin (acetum) yang berarti cuka. Asam biasanya mempunyai rasa masam karena di dalamnya terkandung asam asetat.
Vitamin C rasanya juga masam karena di dalamnya terkandung asam aksorbat. Buah jeruk nipis pun mempunyai rasa asam karena mengandung asam sitrat. Sedangkan basa ditandai dengan rasa pahit dan licin bila dipegang. Contohnya kapur sirih mempunyai rasa pahit dan sabun dipegang terasa licin.
Baca juga: Reaksi asam basa
Sudah lama diketahui bahwa asam dan basa itu saling menetralkan. Tapi perlu diketahui tidak semua asam dan basa dapat di cicipi yaa, karena ada sebagian yang bersifat toksit (racun) yang bisa berbahaya bagi kesehatan jika secara tidak sengaja kita mencicipinya, jadi tidak boleh sembarangan nyicip ya. Untuk menentukan larutan asam dan basa suatu sampel dapat diuji dengan menggunakan indikator.
Teori Asam Basa dan Garam
Teori Asam
Untuk menjelaskan sifat asam dan basa dapat diterangkan berdasarkan berdasarkan teori asam basa menurut Arrhenius. Asam didefinisikan sebagai zat-zat yang dapat memberikan ion hidrogen (H+) atau ion hidronium (H3O+) bia dilarutkan dalam air.
Contoh :
- Asam klorida dan air:
HCl (aq) → H+ (aq) + Cl–(aq)
Ion klorida
- Asam nitrat dalam air:
HNO3 (aq) → H+(aq) + NO3– (aq)
Ion nitrat
- Asam sulfat dalam air:
H2SO4 (aq) → 2 H+ (aq) + SO42- (aq)
Ion sulfat
Berdasarkan rumusnya terlihat setiap asam mengandung unsur hidrogen. ciri khas asam dalam pelarut ialah pelarut air yang mengion menjadi hidrogen yang bermuatan positif (H+) dan yang lainya disebut sebagai sisa asam karena ionnya bermuatan negatif.
Ion H+ inilah yang menjadi dasar pembawa sifat asam dan yang menyebabkan warna lakmus biru menjadi merah. Jadi, asam adalah senyawa yang jika dilarutkan dalam air mengahsilkan ion H+ dan dapat mengubah warna lakmus biru menjadi merah, inilah yang menjadi poin ciri khas dari asam.
Tidak semua senyawa hidrogen adalah asam, misalnya, C2H5OH. Demikian pula semua hidrogen dalam rumus kimia suatu asam dalam larutan dapat dilepaskan sebagai ion H+. Dalam rumus kimia asam asetat mempunyai empat atom hidrogen tetapi hanya satu atom H saja yang dapat dilepaskan sebagai ion H+.
CH3COOH (aq) → H+ (aq) + CH3COOH– (aq)
Ion asetat
Asam kuat adalah asam yang dalam larutan banyak menghasilkan H+, sedangkan asam lemah ialah asam yang sedikit menghasilkan ion H+, sifat kuat atau lemahnya dari asam dapat diselidiki dengan alat uji elektrolit. Berdasrkan jumlah ion H+ yang dilepaskan oleh asam bisa disebut valensi asam.
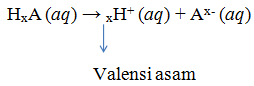
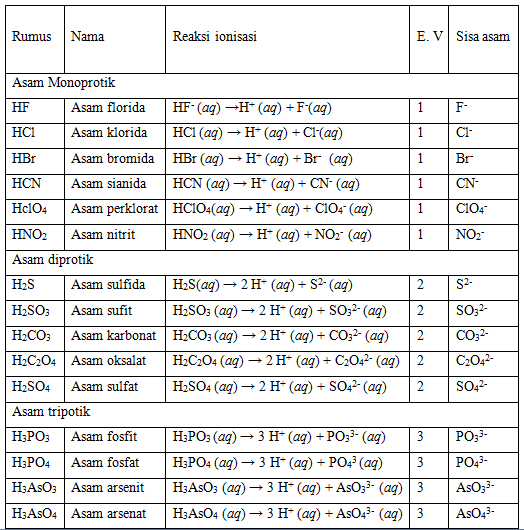
Asam monoprotik ialah satu molekul asam yang dalam pelarut air dapat memberikan satu ion H+ dan yang dapat memberikan dua ion H+ dalam larutannya disebut asam diprotik, sedangkan yang dapat memberikan 3 ion H+ dalam larutannya disebut asam triprotik.
Baca juga: Larutan elektrolit dan non elektrolit
Tabel 1. Barbagai jenis asam
Teori Basa
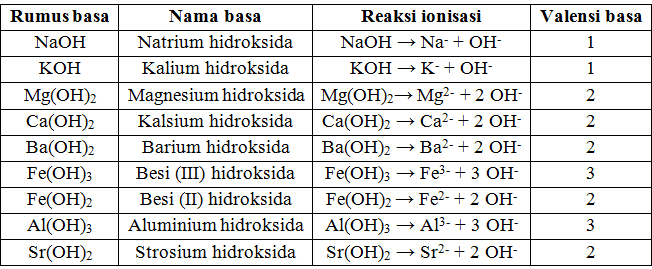
Basa didefinisan sebagai suatu senyawa yang jika dilarutkan ke dalam air akan menghasilkan ion hidroksida (OH–). Yang menyebabkan adanya sifat basa adalah ion OH–.
Contoh:
- Natrium hidroksida dalam air.
NaOH (aq) → Na+ (aq) + OH– (aq)
- Gas amonia dalam air
NH3 (g) + H2O (l) ↔ NH4+ (aq) + OH– (aq)
- Kalium hidroksida dalam air
KOH(aq) → K+(aq) + OH– (aq)
- Karbon hidroksida dalam air
Ca (OH)2 (aq) → Ca2+ (aq) + 2 OH– (aq)
Berdasarkan persamaan reaksi ionisasi basa di atas senyawa basa dalam air akan terionisasi menghasilkan ion OH–, dan sifat basa disebabkan adanya ion OH–. Ion OH– inilah sifat yang membawa sifat basa yang dapat menyebabkan warna lakmus merah berubah menjadi biru.
Baca juga: Kemolalan dan kemolaran
Basa yang dalam larutan banyak menghasilkan ion OH– disebut basa kuat, sedangkan larutan yang sedikit menghasilkan ion OH– disebut basa lemah. Tidak semua senyawa yang dalam rumus kimianya terdapat gugus hidroksida termasuk golongan basa.
Contohnya:
Etil akkohol = C2H5OH
Metil alkohol = CH3OH
Gugus hidroksil pada etil alkohol dan metil alkohol tersebut dalam larutan tidak dapat di lepaskan sebagai ion OH–.
Tabel 2. Jenis-jenis basa
Baca juga: Sifat koligatif larutan
Nah, bila ada pertanyaan tentang Teori Asam Basa dan Garam di atas bisa ditulis di kotak komentar. Nah, untuk garam akan kita bahas di halaman selanjutnya.
Referensi
Harnanto Ari dan Ruminten. (2009). Kimia Untuk SMA Dan MA Kelas XI. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas X1 Program Ilmu Alam: Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.