Rangkuman Contoh Sifat Kolegatif Larutan – Pada pebahasan sebelumnya kita telah membahas konsentrasi larutan tentang bagaimana cara menghitung kemolalan suatu unsur dan cara mencari nilai fraksi mol.
Nah, sekarang pembahasannya masih sama yaitu tentang sifat koligatif larutan, adapun yang akan dibahas dalam pembahasan ini adalah pengertian sifat koligatif larutan, sifat koligatif larutan nonelektrolit, sifat koligatif larutan elektrolit, rumus sifat koligatif larutan beserta contoh soal sifat koligatif larutan.
Simak penjelasan dibawah ini ya agar kalian paham tentang sifat koligatif larutan.
A. Pengertian sifat koligatif larutan
Sifat koligatif larutan adalah sifat yang bergantung pada jumlah partikel zat terlarut dan tidak bergantung pada jenis zat terlarut. Besarnya perubahan bergantung pada jumlah pertikel zat terlarut dalam larutan. Perhatikan pembahasannya berikut.
Kalau kita melarutkan suatu zat terlarut dalam suatu pelarut murni, maka kemungkinan besar akan terjadi hal-hal sebagai berikut:
- Pada larutan akan lebih sukar menguap jika dibandingkan dengan pelarut murninya karena pada larutan akan mengalami penurunan tekanan uap akibat adanya pertikel larutan.
- Jika dididihkan, larutan akan mendidih pada suhu yang lebih tinggi jika dibandingkan pelarut murinya. Akibat adanya partikel larutan akan terjadi penurunan titik beku.
- Jika dibekukan, larutan akan membeku pada suhu yang lebih kecil atau dibawah suhu membeku pelarut murninya. Akibat adanya partikel larutan akan terjadi penurunan titik beku.
- Jika larutan dihubungkan dengan pelarut murninya melewati membran semipermiabel, maka larutan akan mengalami kenaikan volume akibat tekanan osmotik.
Nah, selanjutnya kita akan membahas Rangkuman Contoh Sifat Kolegatif Larutan , perhatikan pembahasan berikut ini.

B. Jenis Sifat Koligatif Larutan
1) Sifat koligatif larutan nonelektrolit
Sifat pelarut murni berbeda dengan sifat larutannya. Contoh , air murni membeku pada suhu 00C, tetapi larutan glukosa akan membeku pada suhu yang lebih rendah dari 00C. Penambahan zat nonelektrolit, misalnya etilen glikol pada radiator mobil akan menurunkan titik beku air dalam radiator, jadi pada suhu 00C air radiator tidak akan membeku.
Penurunan titik beku merupakan salah satu contoh sifat koligatif larutan yang bergantung pada jumlah pertikel zat terlarut dan tidak bergantung pada jenis pertikelnya. Jadi, pada larutan yang berbeda jenisnya tetapi memiliki jumlah pertikel sama, akan memiliki sifat koligatif yang sama pula.
1. Penurunan tekanan uap larutan
Bila kita mengamati pada peristiwa penguapan, ketika pertikel-partikel zat cair meninggalkan kelompoknya. Bila zat cair disimpan dalam ruang tertutup yang hampa udara, maka sebagian dari pertikel-partikel zat cair akan menguap, sedangkan zat car yang telah menjadi uap akan kembali menjadi cair (mengembun). Tekanan yang ditimbulkan pada saat tercapai kondisi kesetimbangan dinamakan tekana uap jenuh.
Dari hasil pengukuran data-data ekseperimen ternyata diketahui bahwa tekanan uap jenuh larutan lebih rendah dari pada tekanan uap jenuh pelarut murni, mangapa demikian ? karena dalam suatu larutan, pertikel-partikel zat terlarut akan menghalangi gerak molekul-molekul pelarut yang berubah menjadi bentuk gas (uap) karena ada interaksi antara zat terlarut dengan pelarutnya.
Oleh karena itu tekanan uap jenuh lebih rendah dari pada tekanan uap jenuh pelarut murni. Makin lemah gaya tarik-menarik antara molekul-molekul zat cair, maka makin mudah zat cair tersebut menguap, artinya makin besar pula tekanan uap jenuhnya. Penurunan tekanan uap jenuh adalah selisih antara tekanan uap jenuh pelarut murni dengan tekanan uap jenuh larutan.
ΔP = Po˗ P
Pengaruh konsentrasi zat terlarut terhadap penurunan tekanan uap jenuh dapat dijelaskan dengan hukum Rault sabagai berikut :
P = Xpelarut . Po
Dari kedua persamaan diatas dapat kita turunkan suatu rumus untuk menghitung penurunan tekanan uap jenuh, yaitu:
ΔP = Po ˗ P
ΔP = Po – (Xpelarut . Po )
ΔP = Po (1- Xpelarut)
ΔP = Po . Xterlarut
Keterangan:
ΔP = penurunan tekanan uap jenuh
Po = tekanan uap pelarut air murni
Xterlarut = fraksi mol terlarut
Xpelarut = fraksi mol pelarut
2. Kenaikan Titik Didih dan Penurunan Titik Beku
Titik didih suatu zat cair adalah suhu dimana tekanan uap jenuh zat cair tersebut sama dengan tekanan luar. Bila tekanan uap sama dengan tekanan luar, maka gelombang uap yang terbentuk dalam cairan dapat mendorong diri ke permukaan menuju fasa gas.
Oleh karena itu, titik didih suatu zat cair akan bergantung pada tekanan luar. Adapun yang dimaksud dengan titik didih adalah titik didih normal pada tekanan 76 cmHg. Adapun titik didih normal air adalah 1000C.
Kenaikan titik didih (ΔTb) adalah selisih titik didih larutan dengan titik didih pelarut. Biasa ditulis dengan persamaan (ΔTb )= titik didih larutan – titik didih pelarut.
Sedangkan selisih antara larutan titik beku pelarut dengan titik beku larutan disebut penurunan titik beku (ΔTf) [( ΔTf ) = titik beku pelarut – titik beku larutan]
Adapaun kenaikan titik didih dan penurunan titik beku yang disebabkan oleh penambahan zat terlarut dapat dirumuskan sebagai berikut:

Dengan:
ΔTb = kenaikan titik didih
ΔTf = kenaikan titik beku
Kb = tetapan kenaikan titik didih molal (oC/m)
Kf = tetapan penurunan titik beku molal (oC/m)
m = molalitas
g = massa zat terlarut (gram)
Mr = massa rumus relatif zat terlarut
p = massa pelarut (gram)
3. Tekanan osmotik
Tekanan osmosis adalah peristiwa perpindahan pelarut dari larutan yang konsentrasinya lebih kecil ke larutan yang konsentrasinya lebih besar melalui membran semipermeabel.
Aliran zat cair dari larutan yang konsentrasinya lebih kecil menuju larutan yang konsentrasinya lebih besar melalui membran semipermeable akan terhenti, bila telah terjadi kesetimbangan konsentrasi antara kedua larutan tersebut.
Adapun yang dimaksud dengan ‘Tekanan osmotik (ð) adalah besarnya suatu tekanan yang akan diberikan pada suatu larutan untuk mencegah mengalirnya molekul dari pelarut ke dalam larutan melalui membran semipermeabel’.
Besarnya tekanan osmotik sesuai dengan persamaan gas ideal , yaitu:

keterangan :
ð = tekanan osmotik
M = konsentrasi (mol/L)
R = tetapan gas (0,082)
T = suhu (K)
Dalam suatu sistem osmosis, larutan yang memiliki tekanan osmosis sama disebut isotonik, bila tekanan osmotiknya lebih kecil dari larutan yang lain disebut hipotonik, dan bila tekanan osmotiknya lebih besar dibandingkan larutan yang lain disebut hipertonik.
2) Sifat Koligatif Larutan Elektrolit
Perlu diketahui bahwa larutan elektrolit ternyata memiliki harga sifat koligatif larutan yang lebih tinggi daripada larutan yang nonelektrolit untuk konsentrasi yang sama.
Dalam konsentrasi yang sama, larutan elektrolit akan mengandung jumlah partikel yang lebih banyak daripada larutan nonelektrolit. Harga koligatif larutan elektrolit dipengaruhi oleh faktor Van’t Hoff (i) dengan persamaan sebagai berikut :
i = [ 1 + α (n-1)]
Keterangan :
n = jumlah ion
α = derajat ionisasi
Untuk n = 2 (biner)
n = 3 (terner)
n = 4 (kuartener)
n = 5 (pentaner)
Untuk α = 1 (elektrolit kuat)
α = 0 (nonelektrolit)
0 < α < 1 (elektrolit lemah)
Maka persamaan sifat koligatifnya dapat dirumuskan sebagai berikut:
ΔP = Xterlarut . PO . i
ΔTb = m . Kb . i
ΔTf = m . Kf . i
π = M . R .T . i
Untuk lebih memahami semua materi di atas, mari simak contoh soal di bawah ini 🙂
C. Contoh Soal dan Jawaban Sifat Kolegatif Larutan
Contoh soal
1. Sebanyak 40 gram glukosa C6H12O6 dilarutkan dalam 200 mL air. Bila Kb = 0,52 0C/m, tentukan titik didih larutan tersebut!
2. Sebanyak 2,8 gram urea, CO (NH2)2 dilarutkan dalam 100 mL air. Tentukan titik beku larutan tersebut! Jika diketahui Kf air = 1,86 0C/m; Ar C = 12, N = 14, O = 16.
3. Sebanyak 17,1 gram tebu C12H22O11 dilarutkan dalam air sehingga volumenya menjadi 500 mL. Bila Ar C = 12, O = 16, H = 1 berapakah tekanan osmotiknya pada suhu 27 oC ?
Jawaban :
1. Diketahui :
g = 40
P = 200 mL
Kb = 0,52 0C/m
Mr C6H12O6 = 180
Ditanya ΔTb?

Titik didih larutan glukosa = 100 + 0,572 = 100,572 oC
2. Diketahui :
g = 2,8 gram
Mr CO (NH2)2 = 60
P = 100
Kf = 1,86
Ditanya ΔTf ?
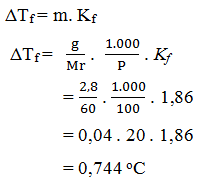
Jadi titik beku larutan urea CO (NH2)2 = 0 – 0,744 oC = – 0,744 oC
3. Diketahui :
g = 17,1
Mr = 342
V = 500 mL
R = 0,82
T = 300
Ditanya ð ?

Oke, baiklah sampai disini dulu pembahasan kita tentang Rangkuman Contoh Sifat Kolegatif Larutan . Kalau ada yang ingin ditanyakan silahkan di kolom komentar yaa. Terimakasih 🙂
Jangan lupa baca juga: Perbedaan larutan elektrolit dan nonelektrolit
Referensi
Lustiyati D E, dkk. 2009. Aktif Belajar Kimia Kelas XII SMA Dan MA. Jakarta: Pusat Pembukuan Departemen Pendidikan Nasional.
Utami Budi, dkk. 2009. Buku Kimia Untuk SMA/MA Kelas XII Program Ilmu Alam. Jakarta. Pusat Pembukuan Departemen Pendidikan Nasional.