Asam Basa Menurut Bronsted Lowry – Sebelumnya kita telah membahas tentang teori asam basa pada pembahasan sebelumnya, tentunya tidak asing lagi bagi kalian jika mendengar kata asam basa.
Asam basa mempunyai ciri khas masing-masing, asam ditandai dengan rasa masam dan basa ditandai dengan rasa pahit, untuk diketahui bahwa sesuatu yang bersifat asam dan basa tidak bisa di cicipi karena sebagian ada yang bersifat toksit (racun).
Teori Asam Basa Menurut Browted Lowry
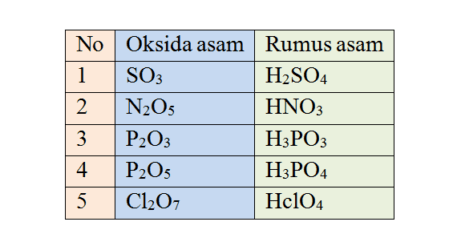
Teori asam basa banyak di kemukakan oleh beberapa ilmuan terkenal seperti Arhenius, Browted Lowry, dan teori asam basa Lewis. Namun sekarang kita hanya fokus pada teori asam basa menurut Bronsted lowry.
Asam basa menurut Bronsted Lowry melengkapi kelemahan dari teori Arrhenius yang menyatakan bahwa asam merupakan senyawa hidrogen yang jika dilarutkan dalam air akan menghaslkan ion H+ dalam larutan, sedangkan basa adalah suatu senyawa yang bila dilarutkan dalam air akan menghasilkan ion OH– dalam larutan, namun pada teori Arrhenius tidak dapat menjelaskan fakta-fakta yang baru ditemukan, karena hanya dapat menjelaskan senyawa-senyawa dengan rumus kimia HA untuk asam dan LOH untuk basa.
Baca juga: Indikator asam basa dan hidrolisis garam
Teori asam basa Arrhenius ini tidak dapat menjelaskan bahwa CO2 dalam air bersifat asam atau NH3 dalam air bersifat basa. Kemudian pada tahun 1923 munculah 2 ilmuan bernama Johanes N. Bronsted (1879-1947) seorang ahli kimia dari Denmark dan Thomas Lowry seorang ahli kimia dari Inggris.
Pada tahun 1923 mereka mengemukakan suatu konsep tentang konsep asam basa, konsep tersebut dikenal dengan konsep teori asam basa Bronsted Lowry yang menyatakan teori asam basa sebagai berikut “ Asam adalah senyawa yang dapat memberikan proton (H+) kepada senyawa lain. Disebut juga dengan donor proton. Sedangkan, Basa ialah senyawa yang menerima proton (H+) dari senyawa lain. Disebut juga aseptor proton”.
Persamaan asam basa Bronsted Lowry
Sekarang kita sudah bisa membedakan perbedaan dari ke dua teori asam basa tersebut, dengan menggunakan konsep asam basa menurut Bronsted Lowry maka dapat ditentukan suatu zat bersifat asam atau basa dengan melihat kemampuan dari zat tersebut dalam serah terima proton (H+) dalam larutan.
Baca juga: Sifat kolegatif larutan
Dalam hal ini pelarut yang digunakan tidak terbatas oleh pelarut air saja. Akan tetapi dapat berupa pelarut yang sering dijumpai di laboratorium, misalnya alkohol, amonia caor, dan eter.
Berikut beberapa contohnya:
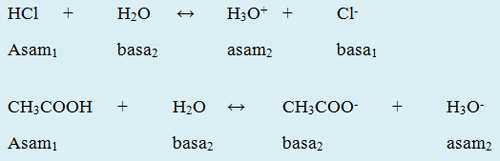
Kedua senyawa HCl dan CH3COOH ini adalah asam karena dapat memberikan ion H+ (proton) kepada H2O. Kedua senyawa ini disebut sebagai donor proton.
Sedangkan Cl– dan CH3COO– adalah basa karena dapat menerima ion H+ (proton) kepada H3O+. Kedua senyawa ini disebut sebagai akseptor proton. Sementara itu, ion H3O+ disebut asam konjugasi, karena terdapat kelebihan proton dibandingkan zat asalnya.
Pasangan lain seperti HCl dan Cl– serta CH3COOH dan CH3COO– disebut pasangan asam basa konjugasi. Secara umum menurut teori asam basa Bronsted Lowry dalam reaksi berikut:
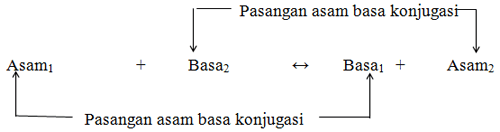
Contoh asam basa Bronsted Lowry
Untuk contoh asam basa Bronsted Lowry ini perhatikanlah tabel berikut:
Tabel 1. Contoh asam basa menurut Bronsted dan Lowry
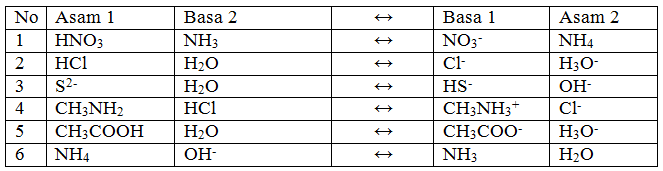
Model atom Bronsted Lowry mendefinisikan suatu spesi sebagai asam atau basa menurut fungsinya di dalam reaksi asam basa atau reaksi transfer proton.
Oleh sebab itu, beberapa spesi dalam reaksi asam basa dapat berperan sebagai asam atau basa. Suatu spesi yang dapat bereaksi sebagai asam atau basa dan bergantung pada jenis pereaksinya dinamaka ampiporotik.
Contoh:
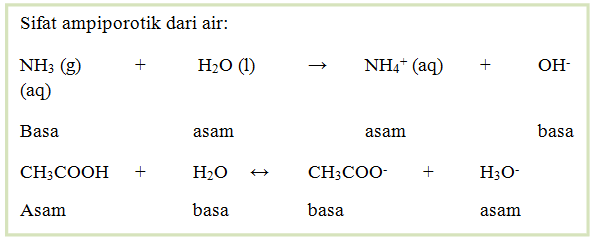
Pada reaski yang pertama, air bereaksi sebagai asam dengan basa NH3, sedangkan pada reaksi kedua, air bereaksi sebagai basa dengan asam CH3COOH.
Baca juga: Kemolalan dan Kemolaran
Dari banyak penjelasan di atas maka dapat di simpulkan bahwa konsep asam basa menurut Bronsted Lowry memiliki cangkupan yang lebih luas, karena hal-hal sebagai berikut:
- Konsep asam basa Bronsted Lowry tidak terbatas dalam pelarut air saja, tetapi juga menjelaskan reaksi asam basa dalam pelarut lain seperti alkohol dan eter.
- Konsep asam basa Bronsted Lowry tidak hanya berupa molekul, tetapi juga dapat berupa kation atau anion. Asam basa Bronsted Lowry dapat menjelaskan sifat asam dari NH4Cl dimana NH4Cl yang bersifat asam adalah NH4+ karena dalam air dapat melepas proton.
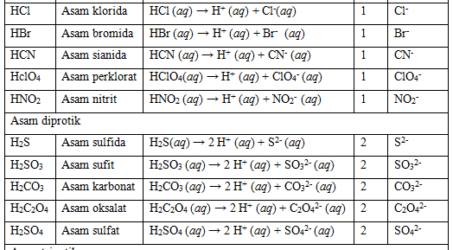
Asam dan Basa Konjugasi
Jika satu asam melepas satu proton maka akan membentuk spesi yang disebut dengan basa konjugasi dari asam tersebut. Sedangkan basa yang telah menerima proton menjadi asam komjugasi. Seperti pada tabel berikut:
Tabel 2. Pembentukan asam konjugasi dan basa konjugasi
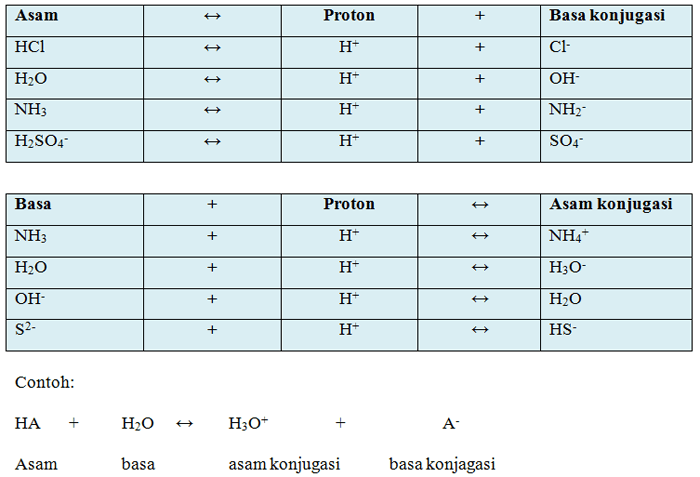
Kelebihan Dan Kelemahan Teori Asam Basa Bronsted Lowry
Teori asam-basa Bronsted-Lowry mempunyai keunggulan dan kelemahan sebagai berikut:
Keunggulan
Dalam teori asam basa Bronsted Lowry tidak ada zat yang bersifat netral. Menurut Bronsted Lowry, setiap zat akan bersifat asam atau basa bergantung apakah ia menerima atau melepaskan proton ion (H+). Selain itu, teori asam basa Bronsted Lowry bersifat luas, tidak hanya bergantung pada pelepasan ion H+ atau OH+, misalnya senyawa NH2–.
Senyawa itu sukar ditentukan sifat asam-basanya berdasarkan teori asam basa Bronsted Lowry, senyawa tersebut dapat ditentukan sifatnya sesuai pasangan reaksinya.
Kelemahan
Kelemahan utama dari teori asam basa bronsted lowry adalah bahwa untuk pelarut yang tidak mengandung proton tidak dapat digunakan. Kelemahan lainnya, sifat suatu zat tidak pasti dan sangat bergantung pada pasangan reaksinya. Misalnya, H2O bersifat asam jika bereaksi dengan NH3 tapi bersifat basa jika beraksi dengan CH3COOH.
Baca juga: Larutan elektrolit dan non elektrolit
Oke, baiklah sampai disini dulu pembahasan kita tentang Asam Basa Menurut Bronsted Lowry ini. Kalau ada yang ingin ditanyakan silahkan di kolom komentar yaa. Terimakasih 🙂
Daftar Pustaka
Harnanto Ari dan Ruminten. (2009). Kimia Untuk SMA Dan MA Kelas XI. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas X1 Program Ilmu Alam: Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta