Indikator Asam Basa dan Hidrolisis Garam – Dari penjelasan di awal bahwa asam dan basa tidak boleh sembarang di cicip karena akan sangat berbahaya jika seandainya tidak sengaja tertelan atau terkotaminasi dengan bagian-bagian tubuh lainnya.
Contohnya asam sulfat (H2SO4) dalam kehidupan sehari-hari biasa digunakan sebagai air aki (accu zuur), bila asam sulfat ini terkontaminasi dengan kulit seperti tangan akan melepuh seperti luka bakar dan apabila terkena mata akan menjadi buta.
Contoh lainnya adalah natrium hidroksida (NaOH) banyak digunakan untuk membersihkan saluran air bak cuci, bila terkena tangan akan menjadi gatal-gatal dan iritasi.
Indikator Asam Basa
Jadi, cara untuk mengenali zat bersifat asam atau basa adalah dengan menggunakan zat petunjuk yang disebut dengan indikator. Indikator asam basa adalah zat yang berbeda warna dengan lingkungan asam basa.
Terdapat beberapa jenis indikator yang dapat digunakan untuk membedakan larutan yang bersifat asam maupun bersifat basa dari suatu larutan, antara lain kertas lakmus, indikator, dan indikator alami.
Kertas lakmus
Indikator yang sering digunakan dalam kegiatan praktikum di laboratorium kimia adalah kertas lakmus merah dan kertas lakmus biru.
Berdasrkan hasil pengujian dengan kertas lakmus dapat disimpulkan bahwa:
- Larutan yang mengandung asam dapat megubah kertas lakmus biru menjadi merah.
- Larutan yang mengandung basa dapat mengubah kertas lakmus merah menjadi biru.
- Larutan netral tidak mengubah warna kertas lakmus.
- Larutan elektrolit ada yang dapat mengubah warna lakmus dan ada yang tidak dapat mengubah warna lakmus, yang dapat mengubah warna lakmus berarti bersifat asam atau basa, dan yang tidak dapat mengubah warna lakmus berarti netral.
- Larutan non elektrolit selalu bersifat netral.
- Indikator universal
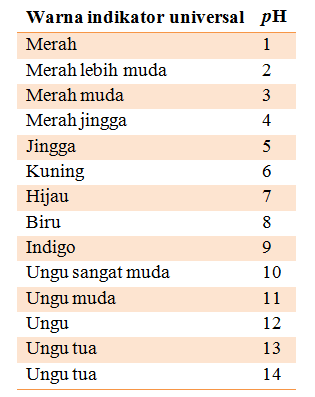
Harga pH suatu larutan dapat di ketahui dengan menggunakan trayek pH indikator.
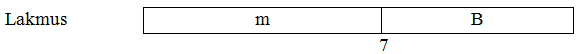
Keterangan warna lakmus:
m = merah
k = kuning
b = biru
tb = tidak berwarna
mu = merah ungu
Indikator Universal
Indikator universal digunakan untuk mengukur pH suatu larutan. Indiktor universal merupakan campuran berbagai indikator yang dapat menunjukkan pH suatu larutan dar perubahan warnanya.
Tabel 3. Warna indikator universal pada larutan pH tertentu
Baca juga: Sifat koligatif larutan
Kekuatan Asam Basa
Hampir semua asam kuat dan basa kuat dalam air semua molekulnya akan terurai menjadi ion-ion. Berdasarkan banyaknya ion yang dihasilkan pada saat ionisasi asam dan basa dalam larutan, maka kekuatan asam dan basa dikelompokkan menjadi asam kuat, asam lemah serta basa kuat dan basa lemah, dari kekuatan asam dan basa tersebut dapat dinyatakan dengan derajat ionisasi.
Derajat ionisasi (α) adalah perbandingan antara jumlah molekul zat yang terionisasi dengan jumlah molekul zat mula-mula’. Derajat ionisasi dapat dinyatakan sebagai berikut:
Derajat ionisasi (α) = Jumlah mol zat terionisasi / jumlah mol zat mula-mula
Larutan elektrolit kuat mengalami ionisasi sempurna, sehingga harga derajat ionisasi (α) mendekati satu. Sementara itu, larutan elektrolit lemah hanya mengalami ionisasi sebagian, sehingga harga derajat ionisasi (α) sangat kecil (α ˂ 1).
Contoh persamaan ionisasi untuk larutan elektrolit kuat:
HCl (aq) → H+ (aq) + Cl– (aq)
Semua molekul HCl teruarai menjadi ion-ionnya, α = 1
Contoh persamaan ionisasi asam lemah: asam asetat
CH3COOH (aq) ↔ CH3COOH– (aq )+ H+ (aq)
1. Tetapan kesetimbangan ionisasi asam lemah
Secara umum persamaan reaksi ionisasi asam lemah dapat dituliskan persamaan sebagai berikut:
HA (aq) ↔ H+ (aq) + A– (aq)
{HA} mula-mula = Ma
Derajat ionisasi HA = α
HA yang terionisasi = Ma .α
HA sisa = Ma – Ma . α
Tetapan kesetimbangan ionisasi asam lemah diberi simbol Ka.

2. Tetapan ionisasi basa lemah
Reaksi ionisasi basa lemah dapat dituliskan sebagai berikut:
LOH (aq) ↔ L+ (aq) + OH– (aq)
[LOH] mula-mula = Mb
Derajat ionisasi LOH = α
LOH yang terionisasi = Mb .α
LOH sisa = Mb – Mb . α
Tetapan kesetimbangan ionisasi asam lemah diberi simbol Kb.
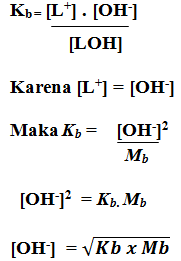
Hidrolisis Garam
Pada pembahasan larutan asam basa telah dipelajari tentang reaksi penetralan, yaitu reaksi antara larutan asam dengan larutan basa yang menghasilkan garam dan air.
Garam yang terbentuk dari reaksi penetralan belum tentu bersifat nertal yaa teman-teman, bisa juga bersifat asam atau basa, tergantug kekuatan asam atau basa yang membentuknya.
Nah, pada pembahasan ini kita akan mempelajari teori yang menjelaskan sifat larutan garam yaitu konsep hidrolisis garam.
Garam (NaCl) yang biasa diknenal dalam bahasa kimia yaitu natrium klorida adalah senyawa ionik yang terdiri dari ion positif (kation) dan ion negatif (anion) sehingga membentuk senyawa. Garam biasanya terbentuk dari hasil reaksi asam dan basa.
Jika suatu garam dilarurtkan ke dalam air, ada dua kemungkinan yang dapat terjadi, yaitu:
- Garam akan bereaksi dengan pelarut air dan akan mengalami hidrolisis dan membentuk ion H+ atau ion OH–. Akibatnya larutan akan bersifat asam atau basa, yang dapat mengalami hidrolisis adalah garam yang mengandung ion elektrolit lemah (ion yang dapat menghantarkan arus listrik).
- Garam tidak bereaksi dengan pelarut air (tidak terhidrolisis) sehingga larutan tetap bersifat netral, yang tidak terhidrolisis adalah garam yang tidak mengandung ion elektrolit lemah (ion yang dapat menghantarkan arus listrik).
Oleh karena itu, garam-garam dibagi ke dalam empat kelompok berdasarkan asam dan basa, garam yang berasal dari:
- Berasal dari asam kuat dan basa kuat. misalnya: NaCl, K2SO4, Ba(NO3)2, dsb.
- Berasal dari asam lemah dan basa lemah. misalnya: CH3COOH, K2CO3, Na3PO4, dsb.
- Berasal dari asam kuat dan basa lemah. Misalnya: NH4Cl, AgNO3, CuSO4, dsb.
- Berasal dari asam lemah dan basa lemah. Misalnya: NH4CN, Al2S3, MgCO3, dsb.
Hidrolisis berasa dari kata hidro yang berasrti air dan lisis yang berarti peruraian, hidrolisis adalah istilah umum untuk reaksi zat dengan air.
Hidrolisis garam sebenarnya adalah reaksi asam basa menurut Bronsted Lowry, komponen garam yang berasal dari asam atau basa lemah merupakan basa atau asam konjgasi yang relatif kuat dapat bereaksi dengan air, sedangkan komponen garam yang berasal dari asam atau basa kuat.
Baca juga: Fraksi Mol
Sifat larutan garam itu tergantung pada kekuatan relatif asam dan basa penyusunnya. Sifat larutan garam disimpulkan pada tabel berikut:
Tabel 4. Sifat larutan garam

Oke, baiklah sampai disini dulu pembahasan kita tentang Indikator Asam Basa dan Hidrolisis Garam . Kalau ada yang ingin ditanyakan silahkan di kolom komentar yaa.
Referensi
Harnanto Ari dan Ruminten. (2009). Kimia Untuk SMA Dan MA Kelas XI. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas X1 Program Ilmu Alam: Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.