Kemolalan, Kemolaran Dan Fraksi Mol – Sebelum kita ke materi inti, aku ingin bertanya terlebih dahulu, karena materi kita selanjutnya ini berkaitan dengan kehidupan sehari-hari yaitu kebiasaan setiap pagi, nge-teh :-).
Manakah yang lebih manis antara kedua larutan yang ada di gelas A dan B ? Jika seandainya gelas A berisi larutan dengan 2 sendok gula dan gelas B berisi larutan dengan 5 sendok gula.
Nah jawabannya pasti lebih manis larutan yang ada di gelas B dong, karena banyak mengandung gula. Artinya gelas B memiliki konsentrasi yang lebih besar dari pada gelas A.

Pertanyaan selanjutnya, Apakah konsentrasi itu ? Nah, Sekarang marilah kita pelajari konsentrasi larutan sebelum kita mempelajari sifat koligatif larutan.
Konsentrasi dapat dinyatakan dalam berbagai cara, diantaranya : kemolalan, kemolaran dan fraksi mol. Namun konsentrasi yang sering dipakai dalam sifat koligatif larutan adalah kemolalan dan fraksi mol. Namun, disini kita akan pilah pilah apa itu kemolalan, kemolaran, dan fraksi mol.
Baca juga: Larutan elektrolit dan non elektrolit
A. Kemolalan (m)
Kemolalan (m) merupakan perbandingan antara jumlah mol zat terlarut dengan massa (kg) zat pelarut. Secara matematik dapat di rumuskan sebagai berikut :
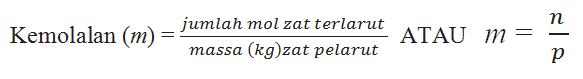
Keterangan :
m = molalitas
n = mol zat terlarut
p = massa za pelarut (gram)
Bila g gram zat terlarut dilarutkan dalam p gram zat pelarut dengan massa rumus relatif (Mr), maka molalitas dapat juga dirumuskan menjadi :
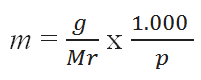
Keterangan :
g = massa zat terlarut (gram)
p = massa zat pelarut (gram)
Mr = massa rumus zat terlarut
Contoh soal molalitas :
1) tentukan kemolalan 0,04 mol HCl yang telah dilatutkan dalam 100 gram air!
2) Sebanyak 1,8 gram glukosa C6H12O6 dilarutkan kedalam 200 gram air jika diketahui Ar C =12; H = 1; dan O = 16. Tentukan molalitas larutan glukosa tersebut !
3) Tentukan berapa ml volume air yang diperlukan untuk melarutkan 4,9 gram H2SO4 yang konsentrasinya 0,25 M jika diketahui nilai Mr dari H2SO4 adalah 98.
Penyelesaian :
1) Jawaban soal pertama
Jumlah mol zat terlarut (HCl) = 0,04 mol HCl

2) Jawaban Soal kedua
Diketahui :
g = 1,8 gram
Mr C6H12O6 = 6. 12 + 12 . 1 + 16.6 = 180
p = 200
Ditanya: molalitas ?
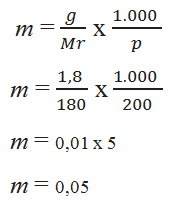
jadi, molalitas C6H12O6 = 0,05 m
3) Jawaban soal ketiga
Diketahui :
g = 4,9 gram
Mr H2SO4 = 2. 1 + 1 . 32 + 4.16 = 98
m = 0,25 M
Ditanya: volume (p) ?
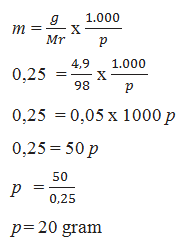
jadi, volume air = 20 mL
Baca juga: Contoh soal dan perhitungan mol
B. Kemolaran (M)
Pada saat kamu memasuki laboratorium kimia, pasti tidak jarang kalian temukan tulisan yang tertera pada botol wadah larutan yang telah di beri kertas label bertuliskan 0,5 M HCl, 0,1 M H2SO4, 0,5 KMNO4, dan lain sebagainya.
Pernakah kalian berfikir apakah arti dari 0,5 M tersebut ? 0,5 M HCl itu artinya bahwa larutan HCl mengandung 0,5 mol HCl dalam air yang cukup untuk membuat volume total 1 liter.
Jadi dapat kita simpulkan molaritas (M) adalah jumlah mol zat terlarut dalam 1 liter larutan. Secara matematik dinyatakan sebagai berikut :
M = n/V
Keterangan:
M = molaritas
n = mol
V = volume
Contoh soal molaritas
Hitunglah konsentrasi larutan yang dibuat dari 18 gram kristal MgSO4 yang dilarutkan kedalam wadah yang berisi 0,25 L air jika diketahui Mr MgSO4 = 120 !
Penyelesaian:
Diketahui :
Massa MgSO4 = 18 gram
Volume air = 0,25 L
Ditanya : Molaritas (M)…?
Penyelesaian :
Mol (n) = Massa MgSO4 / Mr MgSO4
Mol (n) = 18/120 mol
Mol (n) = 0,15 mol
Kemudian…
M = n/V
M = 0,15 mol / 0,25 L
M = 0,6 M
Jadi, konsentrasi larutan MgSO4 adalah 0,6 M.
Baca juga: Reaksi oksidasi dan reduksi
C. Fraksi mol
Salah satu cara untuk menyatakan banyaknya partikel zat terlarut dan zat pelarut dalam suatu larutan adalah dengan besaran fraksi mol zat terlarut dan fraksi mol zat pelarut. Perbandingan jumlah mol zat pelarut dengan jumlah mol total larutan dinyatakan dengan fraksi mol pelarut (Xp).
Fraksi mol pelarut (Xp) secara matematik dapat dirumuskan sebagai berikut :
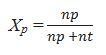
Perbandingan jumlah mol zat terlarut dengan jumlah mol total larutan dinyatakan dengan fraksi mol zat terlarut (Xp). Fraksi mol terlarut (Xp) dapat dirumuskan sebagai berikut :
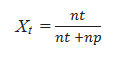
Keterangan :
Xp = fraksi mol zat pelarut
Xt = fraksi mol zat terlarut
np = jumlah mol zat pelarut
nt = jumlah mol zat terlarut
Sehingga fraksi mol total larutan = Xt + Xp = 1.
Untuk lebih memahami tentang fraksi mol perhatikan contoh soal dibawah ini berdasarkan persamaan di atas!
Contoh soal fraksi mol :
Jika 39,875 gram CuSO4 (Mr = 159,5 ) dilarutkan dalam 90 gram air (Mr = 18 ), tentukan fraksi mol zat terlarut dan fraksi mol zat pelarut !
Penyelesaian :
Diketahui :
Massa CuSO4 = 39,875 gram
Mr CuSO4 = 159,5
Massa H2O = 90 gram
Mr H2O = 18
Jumlah mol zat terlarut (CuSO4)
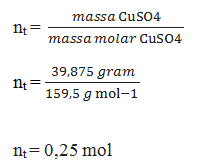
Jumlah mol zat pelarut (H2O)

Jadi, fraksi mol (H2O) = 0,952 dan fraksi mol (CuSO4) = 0,048
Oke, baiklah sampai disini dulu pembahasan kita tentang sifat koligatif larutan tentang perhitungan kemolalan, kemolaran dan fraksi mol. Kalau ada yang ingin ditanyakan silahkan di kolom komentar yaa. Terimakasih 🙂
Referensi
Lustiyati D E, dkk. 2009. Aktif Belajar Kimia Kelas XII SMA Dan MA. Jakarta: Pusat Pembukuan Departemen Pendidikan Nasional.
Utami Budi, dkk. 2009. Buku Kimia Untuk SMA/MA Kelas XII Program Ilmu Alam. Jakarta. Pusat Pembukuan Departemen Pendidikan Nasional.