Contoh Soal dan Jawaban Perhitungan Mol – Satuan mol adalah satuan yang digunakan untuk menyatakan sejumlah partikel yang terkandung […]
Penulis: Novi Ambarsari S.pd
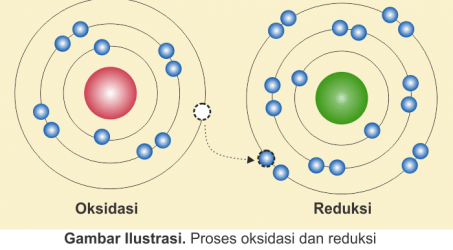
Reaksi Oksidasi dan Reduksi
Reaksi Reduksi dan Oksidasi (Redoks) sering kita temukan dalam kehidupan sehari-hari misalnya pada reaksi pembakaran, pembuatan larutan cuka, reaksi […]
Metode Lumpur Aktif Sebagai Aplikasi Redoks
Metode Lumpur Aktif Sebagai Aplikasi Redoks – Reaksi redoks atau reaksi reduksi dan oksidasi dipelajari dalam kimia dimana pada […]
Atom Karbon dan Senyawa Karbon
Atom Karbon dan Senyawa Karbon – Karbon adalah suatu unsur yang paling banyak ditemukan di muka bumi. Bahkan unsur […]
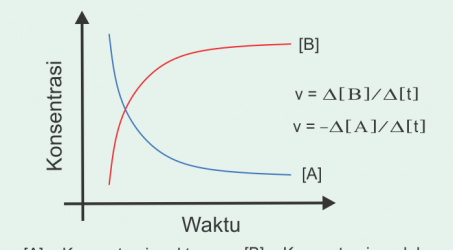
Faktor Yang Mempengaruhi Laju Reaksi Kimia
Faktor yang Mempengaruhi Laju Reaksi Kimia – Di dalam ilmu kimia kita seringkali mendengar istilah reaksi kimia. Reaksi kimia […]
Pengertian dan Rumus Satuan Mol
Pengertian dan Rumus Satuan Mol – Untuk memudahkan dalam mengukur dan mengetahui jumlah benda, kita memerlukan satuan, misalnya 1 […]
Mempelajari Sejarah Hipotesis Avogadro
Mempelajari Sejarah Hipotesis Avogadro – Semua hal mengenai perubahan kimia dipelajari dalam ilmu kimia, dimana di dalamnya kita mengenal […]
Penulisan Persamaan Reaksi Kimia
Penulisan Persamaan Reaksi Kimia – Di dalam ilmu kimia, fokus pembahasan terletak pada materi dan perubahannya, sehingga kita mengenal […]
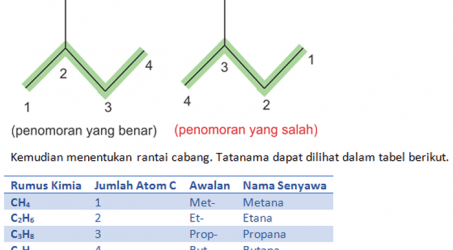
Tata Nama Senyawa Organik
Tata Nama Senyawa Organik – Tata Nama Senyawa berguna untuk mendeskripsikan suatu senyawa berdasarkan gugus fungsi dan rantainya. Penentuan […]
Tata Nama Senyawa Anorganik
Tata Nama Senyawa Anorganik – Di dalam ilmu kimia terdapat banyak senyawa anorganik baik yang terjadi secara alami, maupun […]
Tidak Ada Pos Lagi.
Tidak ada laman yang di load.