Pada halaman sebelumnya kita telah membahas tentang jenis-jenis ikatan kovalen. Nah, sekarang kita akan membahas lanjutannya yaitu kepolaran senyawa kovalen dimana macam-macam ikatan kovalen bedasarkan kepolaran ikatan dapat dibagi menjadi tiga yakni ikatan kovalen nonpolar, polar dan koordinasi.
Tapi sebelum kita membahas lebih jauh, kita harus memahami dulu bahwa sebuah atom dalam suatu ikatan (molekul) itu memiliki kemampuan untuk menarik atau menangkap elektron dari atom lain. Besarnya kemampuannya berbeda-beda untuk setiap atomnya tergantung besar muatan inti atom yang dimiliki. Kemampuan ini kita namakan sebagai sifat keelektronegatifan.
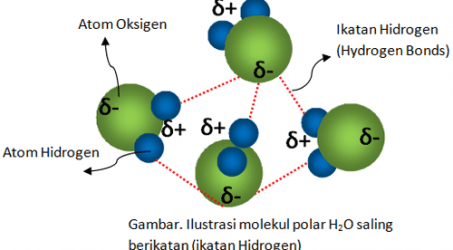
Misalnya pada air (H2O) yang tersusun atas dua atom hidrogen dan satu atom oksigen. Jika kita teliti, kita akan menemukan bahwa oksigen memiliki inti atom yang ukurannya lebih besar karena jumlah proton (muatan positif) di dalam inti jauh lebih banyak daripada jumlah proton di dalam inti atom hidrogen.
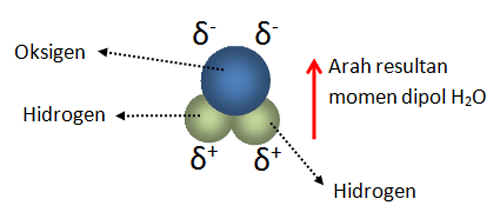
Akibatnya, dua elektron (muatan negatif) yang disumbangkan (untuk digunakan bersama) dari dua buah atom Hidrogen akan lebih ketarik menuju inti atom oksigen. Hal ini mengakibatkan atom oksigen akan menjadi lebih bermuatan negatif daripada dua buah atom hidrogen. Dengan kata lain, dua buah atom hidrogen akan lebih bermuatan positif.
Nah, jika sudah terbentuk dua kutub atau dipol yaitu kutub positif dan kutub negatif dalam molekul H2O ini, maka ini dinamakan sebagai polarisasi. Adapun besar senyawa dipol dinyatakan dalam variabel yang bernama momen dipol.
Ikatan Kovalen Nonpolar, Polar dan Koordinasi
a. Ikatan kovalen nonpolar
Nah, bila dua buah atom atau unsur yang terikat dalam ikatan kovalen memiliki keelektronegatifan yang sama besar, maka tidak akan mengakibatkan pengutuban atau polarisasi muatan. Hal ini kemudian dinamakan sebagain ikatan kovalen nonpolar.
Contoh ikatan kovalen nonpolar: I2, Br2, H2, N2
Misalnya pada I2 dimana elektron digunakan oleh dua inti atom I. Oleh karena keelektronegatifannya sama besar, maka tidak terjadi pengutuban atau polarisasi. Perhatikan gambar di bawah ini.
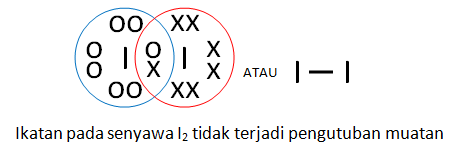
b. Ikatan kovalen polar
Sebuah senyawa terjadi ikatan kovalen polar apabila ada perbedaan kelektronegatifan yang mengakibatkan terjadinya pengutuban muatan. Misalnya pada senyawa HF dimana elektron bersamanya digunakan secara tidak seimbang oleh kedua inti atom H dan inti atom F.
Perhatikanlah gambar berikut ini.
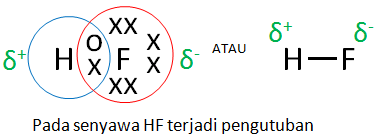
c. Ikatan kovalen koordinasi
Seperti yang kita ketahui bahwa pada ikatan kovalen, biasanya pasangan elektron bersama berasal dari sumbangsih masing-masing atom. Akan tetapi, ternyata ada pula pasangan elektron bersama berasal dari satu atom saja. Nah, ikatan yang seperti ini dinamakan sebagai ikatan kovalen koordinasi.
Contoh ikatan kovalen koordinasi misalnya SO3, HNO3, H2SO4 dan NH4Cl. Nah, untuk menjelaskan ikatan kovalen koordinasi biasanya digunakan tanda anak panah (?).
Misalnya senyawa HNO3 dapat dilihat pada gambar berikut.
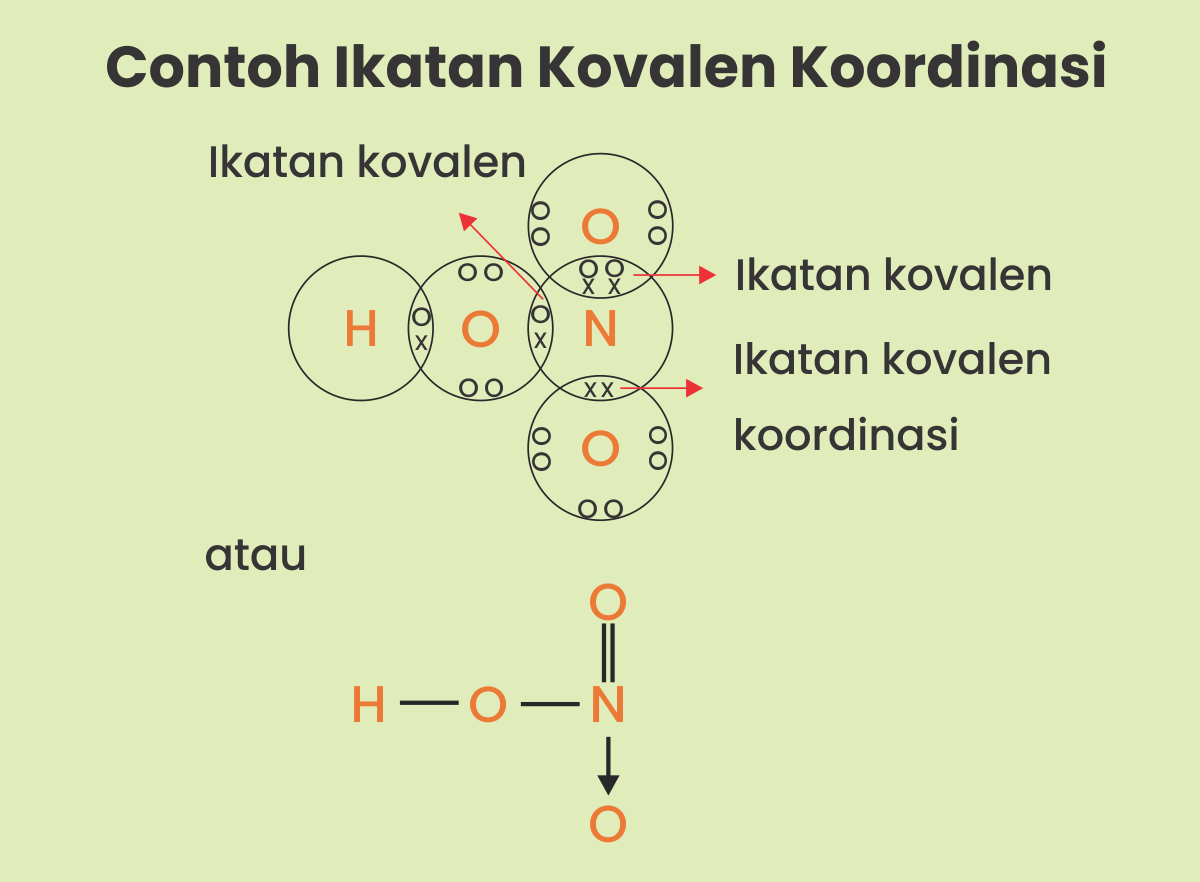
Nah, bila ada pertanyaan terkait Ikatan Kovalen Nonpolar, Polar dan Koordinasi bisa temen-temen tulis di kotak komentar di bawah ini.
Daftar Pustaka:
Rahayu, Iman. 2009. Praktis Belajar Kimia. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.
Permana, Irvan. 2009. Memahami Kimia. Jakarta : Pusat Perbukuan, Departemen Pendidikan Nasional.