Hukum Dasar Ilmu Kimia – Dahulu, banyak ilmuwan mengadakan percobaan dan penelitian dalam ilmu kimia untuk mencari jawaban atas rasa ingin tahunya. Beberapa percobaan yang berhasil tersebut akhirnya melahirkan hukum dasar atau teori yang digunakan hingga sekarang.
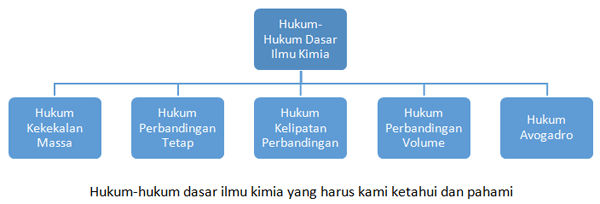
Inilah beberapa hukum-hukum dasar ilmu kimia saat ini:
Rangkuman Hukum-hukum Dasar Ilmu Kimia
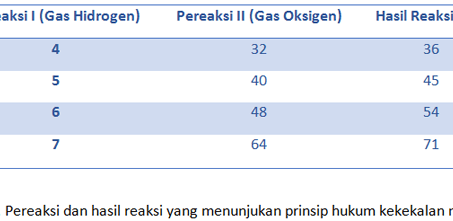
1. Hukum Kekekalan Massa (Hukum Lavoisier)
Hukum kimia yang pertama adalah hukum kekekalan massa. Dahulu seorang ilmuawan bernama Antoine Lavoisier melakukan sebuah penelitian untuk mengetahui proses pembakaran dari beberapa zat yang berbeda. Dalam percobaannya yang terkenal ini ia mengamati pembakaran antara logam cair berwarna putih keperakan dengan raksa atau merkuri. Sehingga terbentuk merkuri oksida berwarna merah.
Merkuri oksida saat itu dikenal dengan merkuri calx yang apabila dibakar akan menghasilkan gas oksigen dan logam merkuri. Begitu juga sebaliknya apabila merkuri dibakar maka akan menghasilkan merkuri oksida. Melalui percobaan tersebut akhirnya diketahui massa oksigen yang digunakan untuk membakar merkuri sama dengan massa oksigen yang dihasilkan jika kita memanaskan merkuri oksida.
Berawal dari percobaan tersebut, maka lahirlah sebuah teori yang disebut dengan Hukum Kekekalan Massa atau Hukum Lavoisier, sesuai nama penemunya. Kesimpulan dari percobaannya adalah bahwa massa zat sebelum reaksi sama dengan massa zat setelah reaksi.
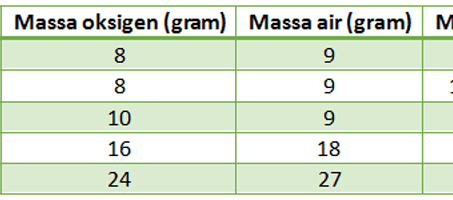
2. Hukum Perbandingan Tetap atau Hukum Proust
Seorang ilmuwan ternama bernama Joseph Louis Proust melakukan sebuah penelitian di tahun 1799. Ia meneliti berbagai senyawa yang berbeda hingga menemukan teori bahwa perbanding massa setiap unsur di dalam suatu senyawa adalah tertentu juga tetap.
Sebagai contoh, jika terdapat dua senyawa yang sama namun keduanya berasal dari sumber yang berbeda maupun dibuat dengan metode yang berbeda, tetap mempunyai komposisi yang sama. Oleh karena itu hukum dasar kimia ini disebut dengan Hukum Perbandingan Tetap atau Hukum Proust.
Melalui Hukum Perbandingan Tetap dari Proust ini kita bisa mengetahui perbandingan massa masing-masing unsur yang menyusun suatu senyawa. Hal ini tentunya berguna dalam penelitian kimia yang mengharuskan kita teliti dalam ukuran.
3. Hukum Kelipatan Perbandingan atau Hukum Dalton
Selanjutnya terdapat hukum Kelipatan Perbandingan atau juga dikenal dengan Hukum Dalton. Di dalam hukum ini dijelaskan bahwa melalui dua unsur yang berbeda dapat dibentuk senyawa yang memiliki perbandingan massa yang berbeda. namun massa salah satu unsur tersebut adalah tetap, dan perbandingan massa yang lain adalah bilangan bulat dan sederhana.
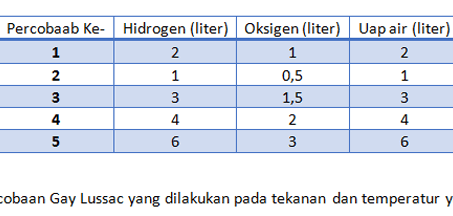
4. Hukum Perbandingan Volume (Hukum Gay-Lussac)
Seorang ilmuwan asal Perancis yang bernama Joseph Louis Gay Lussac melakukan sebuah percobaan yaitu tentang volume gas yang ada dalam berbagai reaksi. Dalam percobaannya ia mendapati bahwa tiap satu satuan volume suatu gas hidrogen akan bereaksi dengan satu satuan volume gas klorin. Reaksi ini akan menghasilkandua satuan gas hidrogen klorida.
Kesimpulan dari percobaan Gay Lussac adalah, volume gas yang bereaksi serta volume gas hasil reaksi jika diukur pada tekanan serta suhu yang sama maka akan berbanding sebagai bilangan sederhana dan bulat.
Di dalam Hipotesis Avogadro dijelaskan bahwa semua gas yang memiliki volume sama akan memiliki jumlah molekul yang sama pada suhu dan tekanan yang sama. Ilmuawan bernama Amadeo Avogadro berpendapat bahwa bagian terkecil zat tidak selalu atau tidak harus atom, namun juga bisa terdiri dari gabungan atom-atom sejenis maupun yang berbeda jenis. Inilah yang disebut sebagai molekul.
Hukum dasar ilmu kimia di atas akan kita bahas lebih detail pada halaman tersendiri.
Referensi:
Brady, James E. 1994. Kimia Universitas Asas dan Struktur, terj. Edisi ke-5 Jilid 1. Jakarta: Erlangga.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.