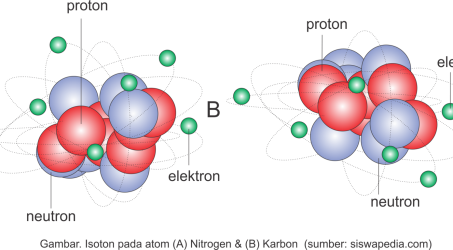
Pembahasan perkembangan teori atom pada halaman ini lebih kita tekankan pada nilai sejarah sehingga kita bisa memiliki gambaran tentang bagaimana teori atom ini mengalami penyempurnaan seiring perkembangan jaman.
Seperti yang telah dijelaskan pada halaman berjudul partikel penyusun atom disitu diterangkan bahwa istilah atom berasal dari bahasa Yunani yang muncul dari sebuah pemikiran bila sebuah materi misalnya kayu, kita potong-potong sampai pada ukuran kecil. Kemudian kita potong terus hingga mencapai bagian ukuran tekecil yang tidak bisa dibagi lagi, maka bagian tersebut kita namakan sebagai atom. Konsep pemikiran ini pertama kali dikemukakan oleh Democritus yang hidup pada tahun 460-370 Sebelum Masehi.
Pendapat democritus ini murni hanyalah berupa pemikiran, bukan penelitian ilmiah yang disertai bukti-bukti dari hasil percobaan. Namun dalam perkembangannya, pemikiran Democritus ini menjadi semacam tantangan bagi kalangan ilmuwan sekaligus membuka pintu penelitian atom hingga saat ini. Siapa saja peneliti yang mencoba menguak misteri atom? Simak penjelasannya berikut ini.
1. Teori atom Dalton
Jhon Dalton (1803) melakukan penelitian terhadap atom dengan menggunakan dua landasan teori yaitu hukum kekekalan massa (berbunyi: “massa zat sebelum dan sesudah reaksi sama”) dan hukum perbandingan tetap (berbunyi:” perbandingan massa unsur-unsur dalam suatu senyawa adalah tetap dan tertentu”).

Ada lima teori yang diajukan oleh Dalton yaitu:
- Atom merupakan partikel terkecil penyusun materi.
- Atom penyusun unsur bersifat identik.
- Atom penyusun unsur tidak dapat dirubah menjadi atom penyusun unsur lainnya.
- Senyawa merupakan gabungan dari dua atom atau lebih dengan perbandingan yang tetap dan tertentu.
- Reaksi kimia terjadi karena pengurangan atau penambahan atom hingga membentuk senyawa yang baru.
Masih bingung dengan istilah materi, unsur dan senyawa? Baca artikel berjudul Materi dan Wujudnya.
Teori atom Jhon Dalton ini hanya bisa bertahan dalam waktu 90 tahun. Pada tahun 1886, Eugene Goldstein menemukan partikel listrik bermuatan positif yang dinamakan proton. Kemudian pada tahun 1897, Thomson menemukan partikel bermuatan negatif yang dinamakan elektron. Disusul pada tahun 1932, James Chadwick juga menemukan muatan netral yang dinamakan neutron. Nah, model atom Jhon Dalton ini dinilai lemah karena tidak mampu menerangkan sifat kelistrikan pada atom.
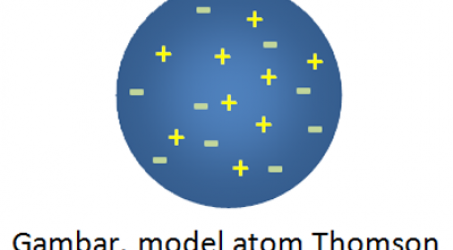
2. Teori atom Thomson
Setelah melakukan percobaan menggunakan tabung sinar katoda, Thomson melihat atom dari sisi sifat kelistriknnya guna memperbaiki teori Dalton yang dinilai lemah. Menurut Thomson atom bersifat netral dimana di dalamnya terdapat muatan positif dan muatan negatif yang saling menetralkan. Model atom Thomson dapat di lihat pada gambar di bawah ini.
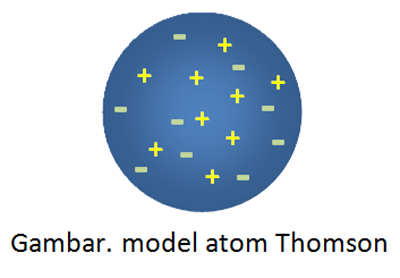
Model atom Thomson ini terkenal dengan sebutan model atom roti kismis karena seperti roti kismis. Atau kalau di Indonesia seperti onde-onde, muatan positif dan negatif itu ya seperti taburan biji wijen pada onde-onde.
3. Teori atom Rutherford
Philipp Lenard pada tahun 1903 berpendapat bahwa teori atom Thomson yang menyatakan atom berbentuk bola pejal dengan muatan positif dan negatif yang saling menetralkan tidaklah benar. Pemikiran ini menjadi inspirasi Ernest Rutherford (1911) untuk melakukan penelitian lebih lanjut dengan dibantu dua asistennya yang bernama Hans Geiger dan Ernest Marsden.
Rutherford melakukan penelitian dengan cara menembakkan partikel alpha (α) yang bermuatan positif ke lempengan tipis emas. Di sekitar lempengan emas telah dipasangi sensor pendeteksi hamburan sinar alpha secara melingkar.
Dari percobaan ini, diperoleh fakta diantaranya:
- Sebagian besar sinar alpha menembus lempengan emas. Itu artinya sinar alpha tidak mengalami tabrakan dengan partikel penyusun atom. Dengan kata lain, di dalam atom terdapat banyak ruang hampa (bukan pejal).
- Sebagian kecil sinar alpha terbelokkan. Ini menandakan telah terjadi tabrakan antara partikel alpha (muatan positif) dengan inti atom (muatan positif). Bahkan ada yang dipantulkan kembali. Nah, yang dipantulkan kembali ini menabrak tepat di tengah inti atom emas.
Kemudian disimpulkan bahwa atom terdiri dari inti atom bermuatan postif dan dikelilingi oleh elektron yang bermuatan negatif dengn lintasan berupa lingkaran atau ellips. Dan mengajukan model atom seperti gambr di bawah ini.
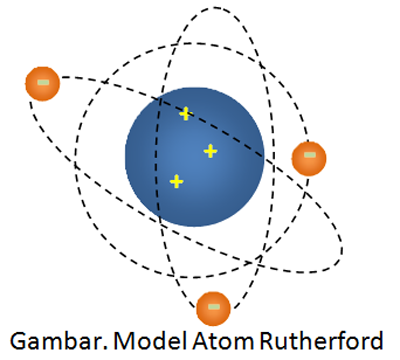
Model atom Rutherford juga dinilai memiliki kelemahan karena tidak bisa menjawab pertanyaan kestabilan atom. Apabila elektron berputar mengelilingi inti, maka ia akan terus mengeluarkan energi sehingga bila energinya habis, maka elektron yang bermuatan negatif akan jatuh ke inti atom yang bermuatan positif (hukum Coulomb). Ini menandakan bahwa menurut model atom Rutherford bahwa atom bersifat tidak stabil . Hal ini bertentangan dengan pehamanan bahwa atom bersifat stabil.
Selain itu, faktanya bahwa spektrum atom hidrogen yang hanya memiliki satu elektron ternyata spektrumnya berbentuk diskrit bukan kontinyu. Bila mengacu pada model atom Rutherford, seharusnya spektrumnya berbentuk kontinyu karena elektron memancarkan energi radiasi.
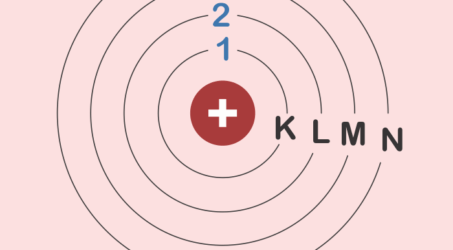
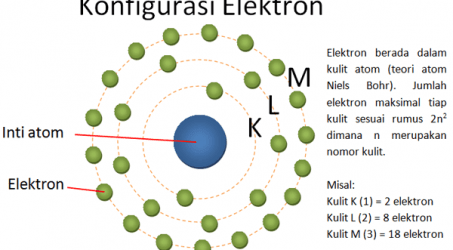
4. Teori atom Niels Bohr
Untuk menyempurnakan teori atom Rutherford, Niels Bohr melakukan pengamatan spektrum atom dengan tetap berpegang teori mekanika kuantum Planck. Ia melakukan pemanasan terhadap atom Hidrogen sehingga mempunyai spektrum yang khas pada tingkatan energi tertentu. Ia melakukan pendekatan sesuai sifat dualisme yaitu sebagai partikel dan gelombang.
Pada tahun 1913, Bohr menyampaikan dua postulat yaitu:
- Elektron yang mengelilingi inti memiliki orbit (kulit) tertentu. Elektron tidak memancarkan atau menyerap energi sehingga hal inilah yang membuat energi elektron konstan.
- Jika elektron menyerap energi dari luar, maka ia akan naik ke kulit/orbit yang lebih tinggi kemudian akan kembali ke kulit/orbitnya yang semula sembari memancarkan energi radiasi.
Model atom Niels Bohr seperti pada gambar di bawah ini.
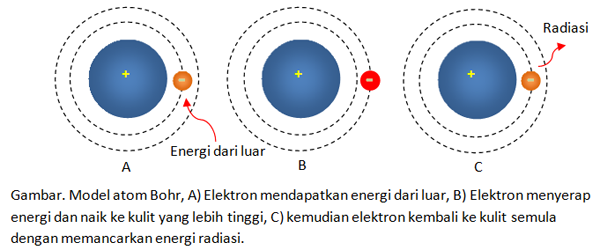
Gambar. Model atom Bohr, A) Elektron mendapatkan energi dari luar, B) Elektron menyerap energi dan naik ke kulit yang lebih tinggi, C) kemudian elektron kembali ke kulit semula dengan memancarkan energi radiasi.
Model atom Bohr ini hanya bisa menjelaskan keadaan atom sederhana, misalnya atom Hidrogen yang hanya dikelilingi satu buah elektron namun tidak bisa menjelaskan keadaan atom yang dikelilingi oleh banyak elektron. Selain itu orbit elektron berbentuk ellips, bukan lingkaran sebagaimana yang dikemukakan Bohr.
5. Teori mekanika kuantum
Setelah penelitian oleh Bohr kemudian penelitian ini dilanjutkan oleh Schrodinger, Heisenberg dan Paul Dirac dimana diketahui bahwa orbital merupakan ruang kebolehjadian ditemukannya elektron. Dan bukan hanya itu saja, sebuah partikel yang bergerak juga dapat memancarkan gelombang. Kita akan membahasnya di halaman lain.
Daftar Pustaka:
Harnanto, Arie dan Ruminten. 2009. Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Zulfikar. 2008. Kimia Kesehatan Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.