Pengertian Serta Contoh Isotop, Isobar dan Isoton – Dalam ilmu kimia dasar, kita akan menjumpai tiga istilah yakni isotop, isobar dan isoton. Apa itu? Apa maknanya?. Nah, di halaman ini kita akan membahas ketiga istilah tersebut beserta contoh dan fungsinya.
Pembahasan tentang isotop, isobar dan isoton merupakan pembahasan dasar dalam ilmu kimia yang kita masukan dalam Bab 01 struktur atom. Silahkan buka kategori tersebut di dalam situs ini bila ingin melihat pembahasan sebelumnya.
A. Isotop
Pengertian isotop: Atom-ataom yang memiliki nomor atom yang sama namun memiliki nomor massa yang berbeda. Dengan kata lain sebuah unsur yang memiliki jumlah proton dan elektron sama dapat memiliki jumlah neutron yang berbeda, itulah yang dinamakan dengan isotop.
Contoh isotop dalam atom:
Hidrogen memiliki isotop 1H1, 2H1 (detrium) dan 3H1 (tritium)
Oksigen memiliki isotop 16O8, 17O8 dan 18O8
Karbon memiliki isotop 12C6, 13C6 dan 14C6
Nitrogen memiliki isotop 14N7 dan 15N7
Helium memiliki isotop 3He2 dan 4He2
Klorin memiliki isotop 35Cl17 dan 37Cl17
Besi memiliki isotop 54Fe26, 55Fe26, 56Fe26,57Fe26 dan 58Fe26
Neon memiliki isotop 20Ne10, 21Ne10 dan 22Ne10
Natrium memiliki isotop 22Na11, 23Na11 dan 24Na11
Belerang memiliki isotop 32S16, 33S16, 34S16 dan 36S16
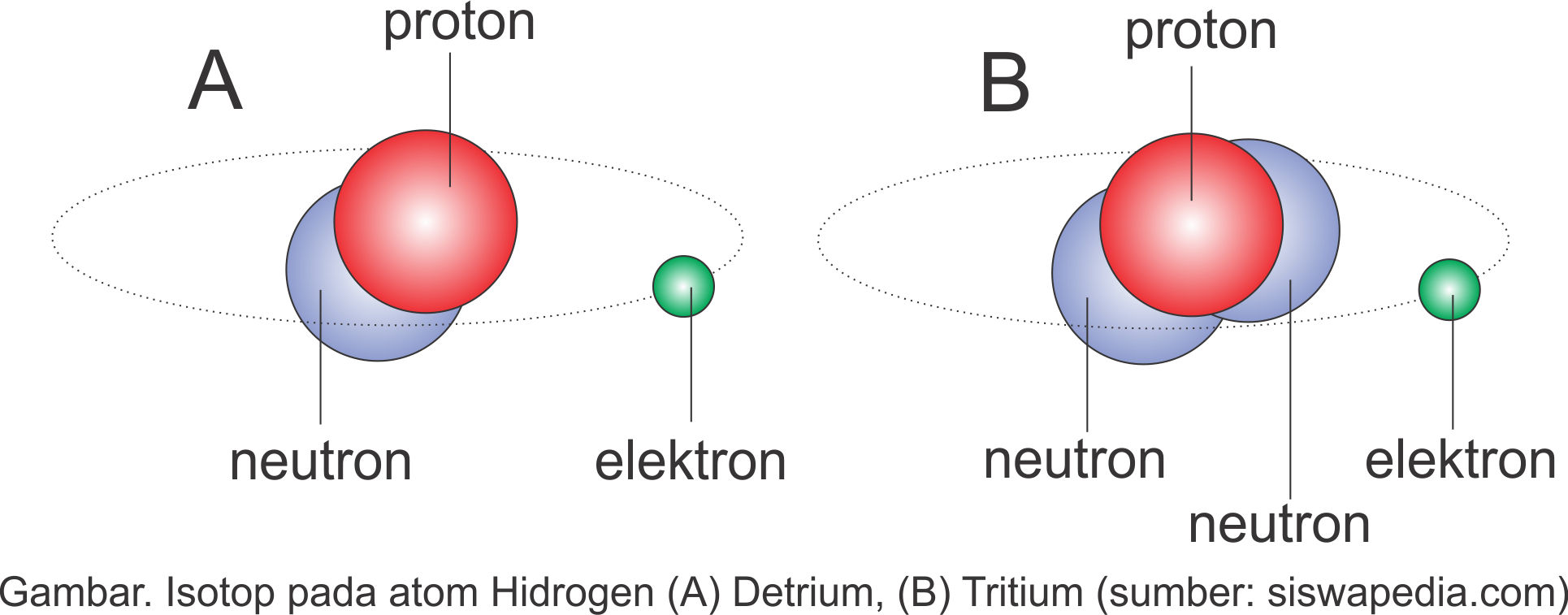
Coba perhatikan sepuluh unsur di atas, meskipun nomor atomnya sama mereka bisa mempunyai nomor massa yang berbeda. Nomor atom adalah jumlah proton sedangkan nomor massa merupakan jumlah proton dan elektron. Silahkan lihat bab sebelumnya.
Kegunaan Isotop dalam kehidupan
- Fe-59 dapat digunakan untuk mengukur laju pembentukan sel darah merah di dalam tubuh
- Na-24 dapat digunakan untuk mendeteksi kebocoran pipa di dalam tanah, caranya Na-24 dilarutkan dalam air/minyak kemudian dengan menggunakan detektor akan diketahui kebocorannya. Yang bocor pasti radiasinya lebih banyak. Selain itu juga bisa digunakan untuk mempelajari peredaran darah manusia.
- P-32 dapat digunakan untuk mendeteksi pemakaian pupuk pada tanaman-tanaman.
- CO-60 dapat digunakan untuk pengobatan kanker.
- I-131 dapat digunakan untuk mendeteksi kelainan pada kalenjar tiroid.
- C-14 daat digunakan untuk mengetahui kecepatan pembentukan senyawa pada proses fotosintesis. Selain itu, juga digunakan untuk menentukan usia fosil atau benda-beda bersejarah. Caranya dengan melihat waktu paruh-nya.
- O-18 dapat digunakan untuk mengetahui perubahan asam karboksilat dan alkohol menjadi suatu ester (dengan menggunakan asam sebagai katalisnya). Ini dinamakan proses esterifikasi.
B. Isobar
Pengertian Isobar: unsur atomnya berbeda namun memiliki nomor massa yang sama. Hal ini dinamakan isobar.
Contoh Isobar
Natrium dan Magnesium dapat mempunyai nomor massa yang sama yaitu 24Na11 dan 24Mg12
Hidrogen dan Helium dapat mempunyai nomor massa yang sama yaitu 3H1 dan 3He2
Karbon dan Nitrogen dapat mempunyai nomor massa yang sama yaitu 14C6 dan 14N7
C. Isoton
Pengertian Isoton: Unsur berbeda namun memiliki jumlah neutron yang sama.
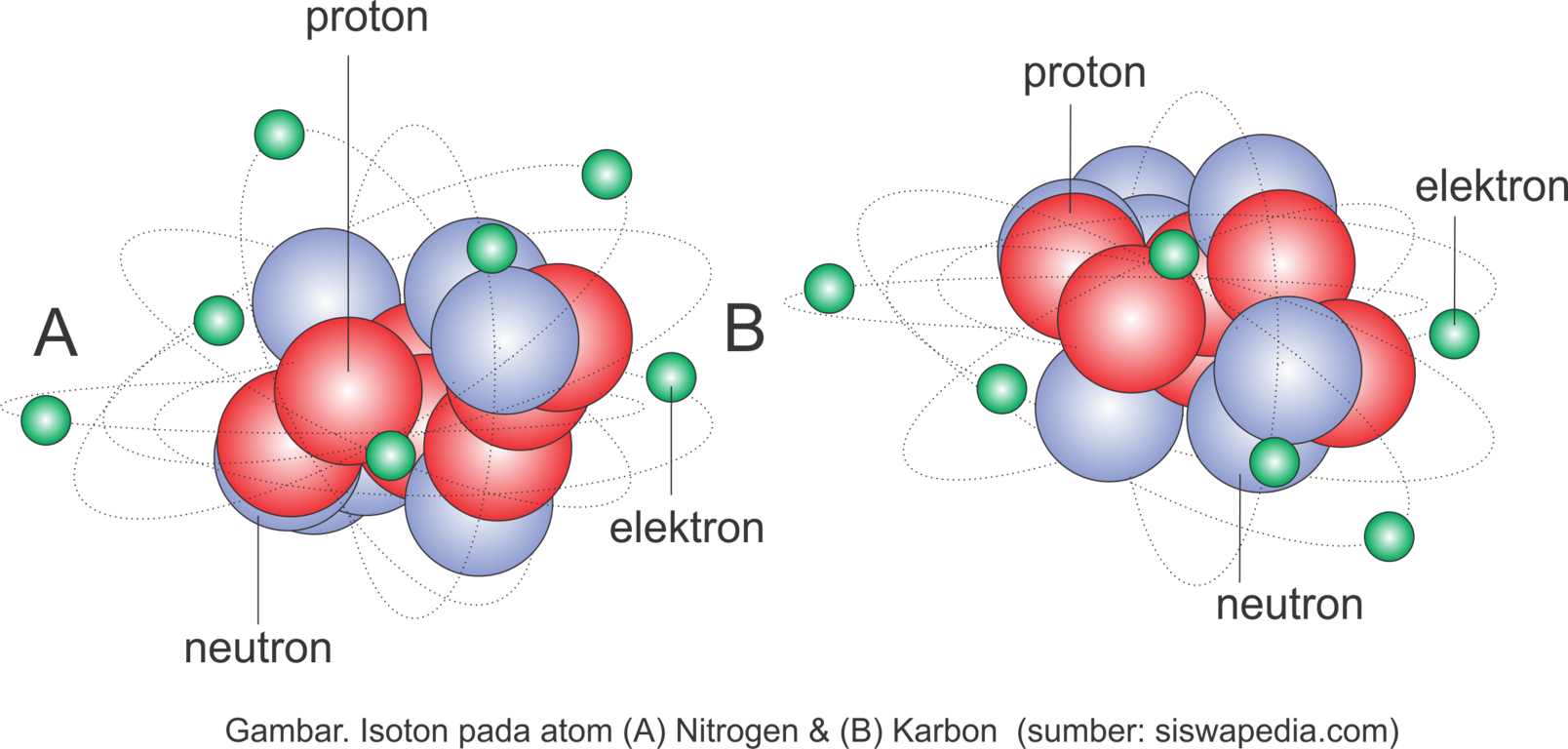
Contoh Isoton
Hidrogen (3H1) dan Helium (3He2) mempunyai jumlah neutron sama yaitu 2.
Argon (40Ar18) dan Kalsium (42Ca20) mempunyai jumlah neutron sama yaitu 22.
Nitrogen(14N7) dan Karbon (13C6) mempunyai jumlah neutron sama yaitu 7.
Natrium (23Na11) dan Magnesium (24Mg12) mempunyai jumlah neutron sama yaitu 12.
Kalium (39K19) dan Kalsium (40Ca20) mempunyai jumlah neutron sama yaitu 20.
Daftar Pustaka
Harnanto, Arie dan Ruminten. 2009. Kimia I. Jakarta: Pusat Perbukuan Departemen Pendidikan Nasional.
Ratna dkk. 2008. Kimia Jilid 1. Jakarta: Direktorat Pembinaan Sekolah Menengah Kejuruan.