Hukum Kelipatan Perbandingan oleh Dalton – Dalam kimia, kita mengenal bahwa senyawa kimia dibentuk dari unsur-unsur tertentu yang berikatan. Sejumlah unsur tertentu yang bergabung akan mengahasilkan senyawa tertentu pula. Namun ternyara ada keteraturan yang terjadi. Hal ini telah diteliti dan dikemukakan pertama kali oleh Joh Dalton, seorang ahli di bidang kimia yang berasal dari Inggris (1766 – 1844).
Hukum kelipatan perbandingan ini menjadi hukum dasar dalam materi stoikiometri. Banyak buku menyebutnya sebagai Hukum Dalton karena ditemukan pertama kali oleh John Dalton. Di tahun 1803 ia menemukannya melalui suatu percobaan sederhana. Hukum Dalton menjadi hukum yang sangat penting untuk memahami bagaimana suatu senyawa terbentuk.
Baca juga: Hukum Avogadro
Setelah Dalton menemukan hukum Kelipatan Perbandingan, ia mulai meneliti tentang atom. Penelitian ini meliputi apakah atom dapat dipecah-pecah lagi. Penelitian tentang atom ini juga didasari oleh hukum-hukum sebelumnya. Dalah pembahasan kali ini akan lebih ditekankan pada penjelasan mengenai bagaimana hukum Kelipatan Perbandingan dapat ditemukan, aplikasinya, dan pengecualian.
Pengamatan dan Penelitian John Dalton
John Dalton melakukan pengamatan terhadap sejumlah senyawa dan akhir ia menemukan keteraturan yang unik. Keteraturan ini terjadi pada perbandingan massa yang dimiliki unsur-unsur yang ada di dalam senyawa. Untuk membuktikan hipotesisnya ini, kemudian John Dalton melakukan serangkan penelitian.
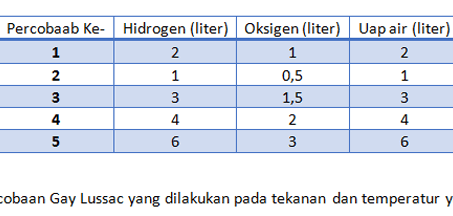
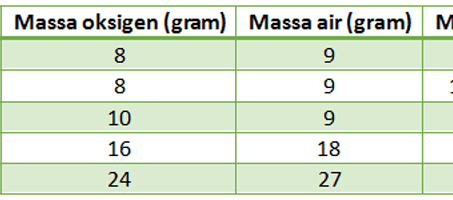
Pertama-tama ia mencoba mereaksikan Nitrogen dengan massa oksigen. Dalam hal ini massa nitrogen diubah-ubah. Sedangkan massa oksigen dibuat tetap atau sama. Kemudian dari hasil percobaannya tersebut akhirnya Dalton mendapatkan hasil yaitu sebagai berikut.

Setelah dibandingkan, Dalton mendapatkan bahwa perbandingan massa diantara keduanya adalah berupa bilangan bulat. Hasil perhitungan didapatkan perbandingan sebesar 2 : 1 untuk massa senyawa NO dan senyawa NO2.
Baca juga: Hukum-hukum dasar dalam ilmu kimia
Bunyi Hukum Kelipatan Perbandingan Oleh Dalton
Setelah mengetahui hasil percobaan tersebut, maka Dalton membuat kesimpulan berupa sebuah hukum kimia. Hukum ini disebut dengan Hukum Perbandingan tetap yang banyak digunakan hingga sekarang. Bunyi hukum tersebut adalah sebagai berikut.
Apabila terdapat 2 unsur berbeda yang bergabung membentuk suatu senyawa lebih dari satu macam, jika massa salah satu unsur dibuat sama atau tepat dan unsur lainnya dibuat berbeda-beda, maka perbandingan massa antar unsur tersebut adalah bilangan bulat dan juga sederhana.

Pembatasan Penggunaan Hukum Kelipatan Perbandingan
Dalam suatu ilmu, kita mengenal berbagai macam hukum atau teori. Berbagai teori dan hukum ini mendasari penemuan teori lainnya dan digunakan dalam penentuan-penentuan untuk menjawab hipotesis. Misalnya dalam suatu penelitian anda membutuhkan suatu dasar yang mampu mendukung hipotesis di dalamnya.
Hukum Kelipatan Perbandingan kita kenal sebagai salah satu hukum dasar yang digunakan dalam materi stoikiometri. Hukum ini memang sangat penting bahkan membuka wawasan akan bagaimana suatu senyawa dapat terbentuk dan bagaimana penyusunnya. Namun hukum ini mengalami pengecualian dalam kondisi tertentu.
Beberapa pengecualian yang bisa terjadi misalnya untuk senyawa-senyawa polimer. Senyawa polimer adalah senyawa yang memiliki rantai sangat panjang bahkan tidak terhingga. Selain itu senyawa non stoikiometrik dan oligomer juga tidak bisa menggunakan hukum Dalton ini.
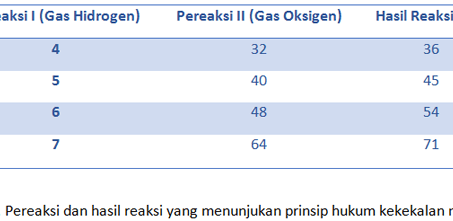
Hukum Dalton digaris bawahi pada pernyataan bahwa perbandingan massa antar unsur yang menyusun suatu senyawa adalah bilangan bulat dan sederhana. Misalnya untuk senyawa CO2 (karbon dioksida) dan CO (karbon monoksida) yang mengikuti kaidah hukum Kelipatan Perbandingan.
Nah, bila ada pertanyaan terkait Hukum Kelipatan Perbandingan oleh Dalton bisa di tulis dikotak komentar.
Sumber :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.