Memahami Hukum Kekekalan Massa Oleh Antonie L. Lavoisier
Hukum Kekekalan Massa Oleh Antonie L. Lavoisier – Antonie Laurent Lavoisier adalah seorang ahli kimia yang lahir pada tahun 1743. Ilmuwan yang berasal dari Prancis ini mendapat julukan sebagai “Bapak Kimia Modern” karena telah mengemukakan penemuannya yang terkenal dan teori-teori kimia modern. Salah satu teori Lavoisier yang paling terkenal adalah Hukum Kekekalan Massa.
Hukum yang mendasari banyak reaksi kimia ini merupakan hukum yang menyatakan bahwa suatu massa (pada sistem yang tertutup) akan tetap meski dalam reaksi terjadi beberapa proses. Jadi, dengan kata lain, massa sebelum dan sesudah reaksi adalah sama dan tetap. Namun dengan catatan bahwa reaksi harus berjalan atau terjadi pada sistem tertutup.
Dahulu konsep kekekalan massa sangat rumit untuk dipahami karena keterlibatan gaya Buoyan atau yang dikenal dengan gaya apung. Namun setelah gaya ini dipahami secara mendalam barulah hukum kekekalan massa dapat dipelajari. Hukum kekekalan massa membuka teori-teori lainya sehingga membuka mata para alkemis terhadap kimia modern.
Baca juga: Memahami Unsur dalam Ilmu Kimia
Percobaan Lavoisier yang Mendasari Hukum Kekekalan Massa
Setiap teori dan hukum kimia didapat berdasarkan pengamatan dan penelitian terhadap suatu perubahan kimia. Hukum kekekalan massa yang dikemukakan oleh Lavoisier ini pun didapat dari hasil percobaan. Ia melalukan percobaan dengan menggunakan merkuri calx atau dikenal dengan merkuri oksida berwarna merah.
Pada mulanya, merkuri calx ini ditempatkan di alat pemanas yang dihubungkan ke tabung penampung udara dan hasil pemanasan. Kemudian zat tersebut dipanaskan pada suhu tertentu. hasil pemanasan selama jangka waktu tertentu ini ternyata menghasilkan gas oksigen (O2) dan logam merkuri.
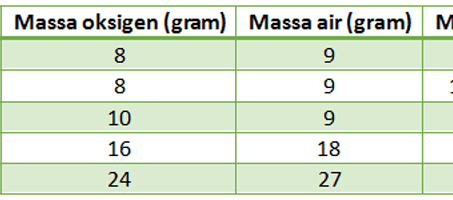
Kemudian, apabila pemanasan ini dibalik, yaitu dilakukan pemanasan terhadap oksigen dan logam merkuri, maka akan dihasilkan senyawa merkuri oksida. Hasil ini menunjukkan suatu keunikan. Massa oksigen yang dihasilkan dari pemanasan merkuri calx sama dengan massa oksigen yang dibutuhkan untuk memanaskan logam merkuri untuk menghasilkan senyawa tersebut.
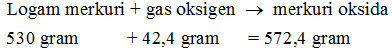
Dalam rangkaian alat yang digunakan oleh Lavoisier dalam percobaannya ini, ia menemukan bahwa mula-mula tabung yang berisi udara A. Tinggi udara A ini kemudian secara perlahan-lahan mengalami kenaikan menjadi B. Hal inilah yang menunjukkan bahwa terdapat sebagian oksigen yang berkurang karena digunakan dalam pemanasan logam merkuri. Akibatnya terbentuklah merkuri oksida.
“Dalam reaksi kimia, massa zat-zat sebelum dan sesudah reaksi adalah sama” ( Hukum Kekekalan Massa Oleh Antonie L. Lavoisier ).
Contoh Aplikasi Hukum Kekekalan Massa
Hukum kekekalan massa yang telah dikemukakan oleh ilmuwan Prancis bernama Lavoisier ini banyak digunakan dalam berbagai bidang. Beberapa bidang tersebut di antaranya adalah teknik kimia, kimia, dinamika fluidan, maupun mekanika.
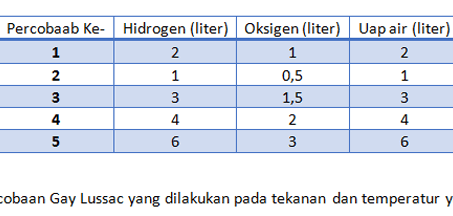
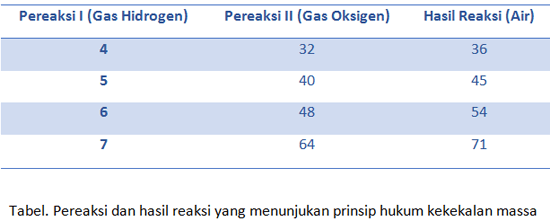
Hukum ini bisa terjadi dalam reaksi pembentukan gas hidrogen dan oksigen yang didapat dari air. prosesnya seperti ini: jika gas oksigen dan juga hidrogen ternyata dibentuk dari 36 gram air, maka ketika reaksi terjadi hingga air bereaksi seluruhnya akan didapatkan produk dengan massa yang sama.
Namun jika pada reaksi tersebut ternyata menyisakan air, maka total massa produk dan air yang sisa adalah tetap 36 gram. Perhatikanlah tabel berikut ini.
Penyimpangan hukum kekekalan massa juga bisa terjadi. Penyimpangan ini bisa ditemukan dalam reaksi kimia yang berjalan di dalam sistem terbuka. Mengapa?
Hal ini tentu saja disebabkan karena adanya proses perubahan energi yang terlibat dan terjadi sangat signifikan. Sebagai contoh, reaksi nuklir yang terjadi pada bintang dimana terdapat reaksi pelepasan sejumlah energi sangat amat besar. Sedangkan di dalam sistem tertutup, energi tidak dapat keluar ataupun masuk. Oleh karena itu tidak ada perubahan energi yang bisa mengganggu reaksi di dalam sistem.
Baca juga: Hukum-hukum dasar dalam ilmu kimia
Daftar Pustaka:
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.