Sifat Fisika dan Kimia Unsur – Jumlah unsur yang ada di muka bumi banyak sekali, baik yang alamiah maupun yang buatan.
Unsur-unsur tersebut disusun dalam tabel periodik yang biasa kita kenal dengan tabel sistim periodik unsur lalu dikelompokkan yang disebut dengan periode dan golongan.
Apa itu periode dan golongan itu?
Periode adalah garis horizontal pada sistem periodik unsur sedangkan golongan adalah unsur dari atas kebawah. Secara garis besar unsur-unsur tersebut dibedakan atas unsur-unsur utama dan unsur-unsur transisi.
Pada bab ini kita akan mempelajari unsur-unsur utama, mempelajari tentang kelimpahan, sifat-sifat, dan manfaat beberapa unsur yang biasa berhubungan dengan kehidupan kita sehari-hari.
Seperti unsur tembaga digunakan sebagai kawat listrik, aluminium digunakan sebagai alat-alat rumah tangga, fluorida untuk pasta gigi, natrium untuk kembang api, neon untuk lampu penerangan, dan masih banyak unsur-unsur lainnya yang akan dibahas.
Keberadaan Unsur di Alam
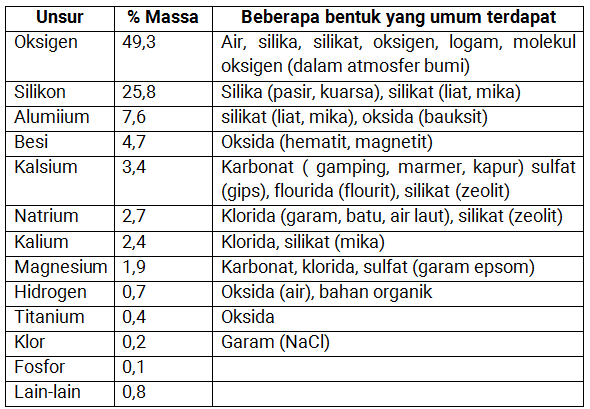
Sampai saat ini sudah dikenal sekitar 110-160 unsur, 92 diantaranya terdapat di alam dan yang lainnya merupakan unsur buatan. Unsur yang paling banyak terdapat di bumi kita ini adalah oksigen, silikon, alumunium, dan besi. Sedangkan helium adalah unsur yang paling banyak terdapat di alam (terdapat di matahari).
Kelimpahan unsur-unsur di kulit bumi
Berikut ini beberapa unsur-unsur yang paling melimpah yang ada di kulit bumi adalah oksigen, silikon, dan alumium.
Sifat fisika dan kimia unsur
a. Golongan IA (alkali)
Golongan IA dalam tabel sistim periodik dikenal juga dengan nama unsur alkali, karena semua anggotanya bereaksi dengan air membentuk larutan alkali.
Adapun anggota golongan alkali dari atas ke bawah berturut turut adalah litium (Li), natrium (Na), kalium (K), rubidium (Rb), sesium (Cs), dan fransium (Fr).
Unsur-unsur alkali disebut juga logam alkali, unsur alkali memiliki ukuran yang lebih besar di antara unsur-unsur dalam satu periode. Makin besar nomor atom, energi ionisasinya makin berkurang.
Hal ini karena semakin besar nomor atom berarti semakin jauh jarak elektron terluar dengan inti atom sehingga makin mudah lepas. Unsur-unsur alkali mempunyai keelektronegatifan kecil. Oleh karena itu unsur alkali membentuk senyawa ion.
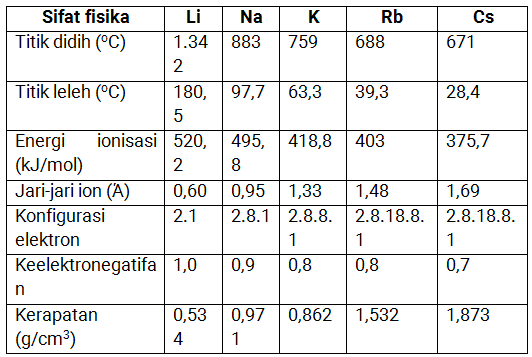
Sifat fisika alkali
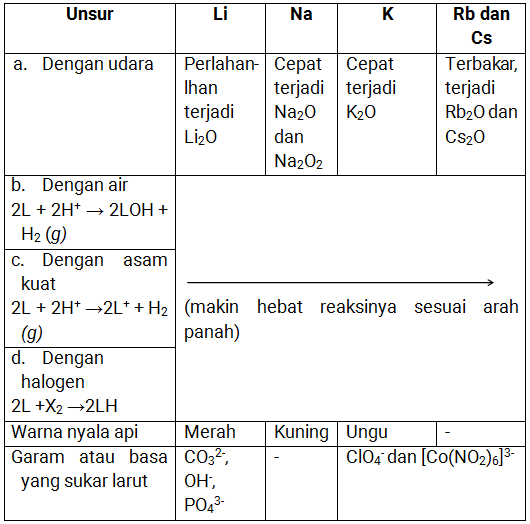
Adapun sifat fisika dari golongan IA (alkali) adalah dapat di lihat dalam tabel di bawah ini:
Sifat Kimia Alkali
b. Golongan IIA (alakali tanah)
Adapun unsur logam alkali tanah (IIA) ini terdiri dari Be, Mg, Ca, Sr, Ba, dan Ra. Pada golongan IIA ini mempunyai sifat-sifat yang mirip dengan golongan IA (alkali). Perbedaannya adalah bahwa golongan IIA ini mempunyai konfigurasi elektron dan merupakan reduktor yang kuat.
Sifat Fisika Alkali Tanah
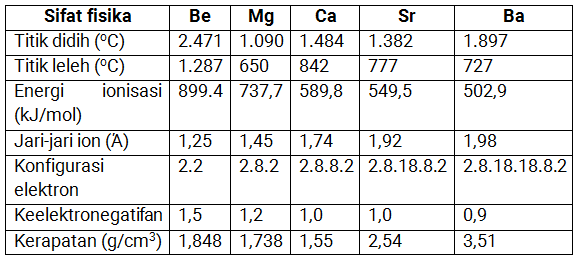
Sifat Kimia Alkali Tanah
Sifat kimia unsur alkali tanah memiliki kesamaan dengan sifat kimia unsur alkali. Magnesium dan berilium memiliki kesamaan sifat kimia yang sama yaitu kurang reaktif, sedangkan kalsium, stronsium, dan barium memiliki sifat yang serupa.
Semua unsur alkali tanah merupakan penyumbang elektron, tergolong reduktor yang kuat. Sifat lain yang dimiliki unsur alkali tanah mudah bereaksi dengan unsur nonlogam membentuk senyawa ion misal halida, hidrida, oksida, dan sulfida.

Sedikit perbedaan antara logam alkali dengan logam alkali tanah, logam alkali cenderung kurang reaktif dibandingkan dengan logam alkali karena energi ionisasinya lebih besar daripada logam alkali tanah, sehingga tren kereaktifannya: Ba > Sr > Ca > Mg > Be.
Baca juga: Manfaat Belerang atau sulfur
c. Golongan IIIA
Unsur-unsur golongan IIIA tidak sereaktif unsur golongan IA dan IIA. Anggota unsur golongan IIIA terdiri dari boron (B), aluminium (Al), gallium (Ga), indium (In), dan talium (Ti).
Sifat Fisika
Boron merupakan unsur pertama dalam golongan IIIA yang berbeda dengan unsur lainya yaitu tergolong metaloid, sedangkan unsur-unsur lainnya tergolong logam.
Reaktivitas unsur-unsur golongan ini tidak ada kecenderungan. Potensial reduksi golongan IIIA tergolong negatif, hal ini menunjukkan bahwa unsur IIIA bersifat lebih logam dibanding hidrogen. Perhatikan sifat-sifat golongan IIIA pada tabel berikut ini:
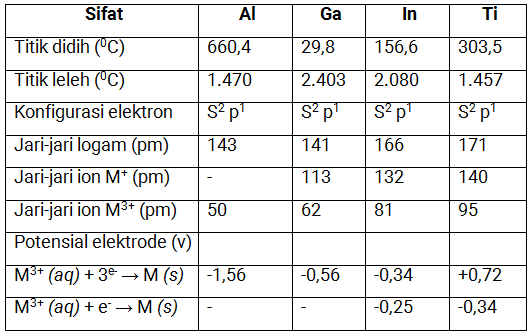
Sifat kimia boron dan aluminium
Boron
Boron merupakan unsur yang tidak reakstif pada suhu biasa, namun bila bereaksi atom boron tidak kehilangan elektron-elektron terluar.
Adapun reaksi pada boron adalah sebagai berikut.
- Reaksi dengan halogen
Secara umun boron bereaksi dengan halogen, kemudian akan terbakar dalam gas fluor.
2 B + 3 X2 → 2 BX3 X= atom halogen
- Membentuk asam oksi
Jika dipanaskan dalam udar, unsur boron bereaksi dengan oksigen dalam pembakaran yang sangat eksotermik untuk oksida B2 O3. Oksida ini bersifat asam dengan reaksi sebagai berikut:
B2O3 (s) + 3 H2O (l) ↔ 2 B3O3 (l) (Asam borat)
Sifat kimia aluminium
Sejumlah garam aluminium seperti halnya logam golongan IIIA dapat mengkristal dalam larutannya akan membentuk hidrat. Misal senyawa AlX3. 6H2O (di mana X = Cl–, Br–, I–). Aluminium bersifat amfoter.
Aluminuum dapat berlaku asam atau basa dikarenakan kecenderungan yang kuat untuk dioksidasi menjadi Al3+. Perhatikan reaksi berikut:
2 Al (s) + 6H2O (l) → 2 Al (OH)3 (aq) +3 H2 (g)
d. Golongan IVA (karbon dan silikon)
Anggota unsur golongan IVA lainnya adalah karbon (C), silikon (Si), germanium (Ge), timah (Sn), plumbum (Pb). Di sini kita hanya akan mempelajari sifat-sifat unsur karbon dan silikon yang umum dipelajari.
Sifat fisika karbon dan silikon
Perhatikan tabel berikut:
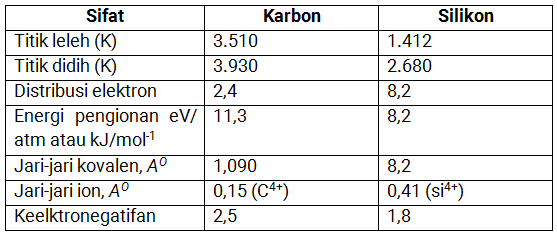
Sifat kimia karbon dan silikon
Karbon dan silikon memiliki sedikit perbedaan yaitu tidak reaktif pada suhu biasa, karbon dan silikon dapat membentuk kation sederhana seperti C4+ dan Si4+.
Sifat kimia karbon antara lain sebagai berikut.
- Karbon dapat bereaksi langsung dengan fluor, seperti berikut reaksinya.
C (s) + 2 F2 (g) → CF4 (g)
- Karbon jika dibakar dalam udara yang terbatas akan menghasilkan karbon monoksida namun jika dibakar dalam keadaan kelebihan udara akan terbentuk karbon dioksida.
2C (s) + O2 (g) → 2 CO (g) (karbon monoksida)
- Membentuk asam oksi
Karbon jika dipanaskan dalam udara akan beraksi dengan oksigen mebentuk CO2. Jika CO2 ini jika direaksikan dengan air akan membentuk asam karbonat.
CO2 (g) + H2O (l) → H4CO3 (l) (Asam karbonat)
e. Golongan VA (Nitrogen dan Fosfor)
Anggota unsur golongan VA adalah nitrogen (N), fosfor (P), arsen (As), antimonium (Sb), bismut (Bi). Namun yang umum dipelajari adalah nitrogen dan fosfor.
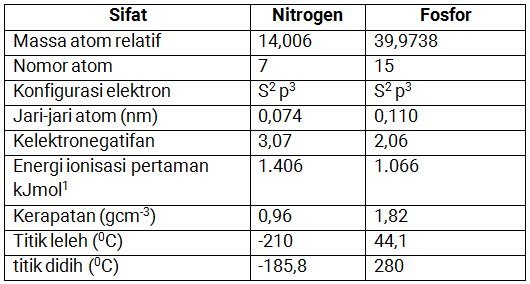
Berikut sifat fisika dan kimia unsur Nitrogen dan Fosfor:
Sifat Fisika Nitrogen dan Fosfor
Masing-masing nitrogen dan fosfor mempunyai bilangan oksidasi terbesar adalah +5, dan sama-sama memiliki elektron valensi dengan konfigurasi elektron ns2 np3. Berikut adalah sifat-sifat fisika nitrogen dan fosfor.
Sifat kimia
Nitrogen adalah salah satu unsur yang unik dalam golongannya, karena dapat membentuk senyawa biloks dari tiga sampai lima. Senyawa nitrogen dapat mengalami reaksi reduksi dan oksidasi. Adapun sifat kimia nitrogen antara lain seperti berikut.
- Reaksi nitrogen dengan oksigen terjadi apabila bereaksi di udara dengan bantuan bunga api listrik tegangan tinggi, dengan reaksi seperti berikut.
N2 (g) + O2 (g) → 2 NO (g)
Selanjutnya senyawa NO akan bereaksi membentuk NO2 dengan reaksi seperti berikut.
2NO (g) + O2 (g) → 2 NO2 (g)
- Nitrogen jika beraksi dengan flour maka akan membentuk nitrogen triflourida dengan reaksi seperti berikut.
N2 (g) + 3 F2 (g) → 2NF2 (g)
- Nitrogen jika direaksikan dengan logam membentuk nitrida ionik, misalnya seperti berikut.
6 Li (s) + N2 → 2Li3N (s)
6 Ba (s) + N2 → 2Ba3N (s)
6 Mg (s) + N2 → 2Mg3N (s)
f. Golongan VIA (Oksigen dan Belerang)
Oksigen dan belerang adalah 2 unsur yang tedapat pada golongan VIA yang umum di bahas diantara unsur lainnya. Ada beberapa anggota lain yang tergabung dalam golongan VIA diantaranya adalah selenium (Se), tellurium (Te), polonium (Po).
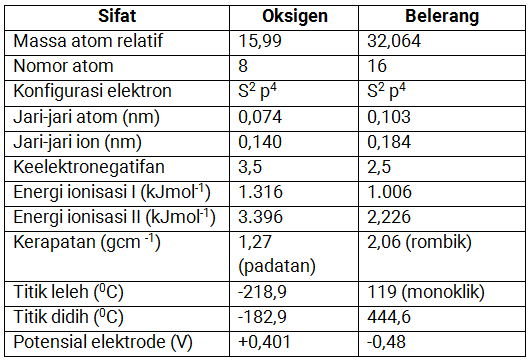
Sifat Fisika
Berikut tabel sifat fisika dari oksigen dan belerang.
Sifat kimia
Sifat kimia oksigen
Oksigen dapat membentuk senyawa jika direaksikan dengan semua unsur, kecuali dengan gas mulia. Bila bereaksi dengan logam akan membentuk ikatan yang bersifat ionik, jika bereaksi dengan unsur non logam akan membentuk ikatan kovalen. Berikut adalah contohnya:
- Oksida asam
SO3 (aq) +H2O (l) →2 H+ (aq) + SO42- (aq)
- Oksida basa, dengan air membentuk basa.
CaO (s) + H2 O (l) → Ca2+ (aq)+ 2 OH2- (aq)
- Oksida amfoter, oksida ini dapat beraksi dengan asam atau basa.
ZnO (s) + 2 HCl (aq) → ZnCl2 (s) + H2 O (l)
Sifat kimia belerang
Untuk mencapai konfigurasi s belerang hanya membutuhkan 2 elektron gari gas mulia.. Belerang akan bertidak sebagai penerima elektron apabila bereaksi dengan logam, belerang juga merupakan unsur yang mudah bereaksi dengan semua unsur kecuali emas, platinum dan gas mulia.
Reaksi-reaksi pada belerang, antara lain seperti berikut.
- Dengan logam
Belerang bereaksi lebih kuat dengan logam.
Contoh: Fe(s) + S(s) → FeS(s)
- Reaksi dengan nonlogam
Belerang bereaksi dengan karbon panas membentuk karbon disulfida.
Contoh: C(s) + S (s) → CS (s)
Sifat kimia dari belerang adalah tidak larut dalam air atau H2SO4 memiliki titik lebur 129oCdan titik didihnya 446oC. Belerang mudah larut dalam CS2, CCl4, minyak bumi, minyak tanah, dan anilin. Merupakan penghantar panas dan listrik yang buruk dan apabila di bakar apinya berwarna biru dan menghasilkan gas-gas SO2 yang berbau busuk.
Demikian pembahasan kita tentang Sifat Fisika dan Kimia Unsur ini, semoga tulisan ini bisa memberi manfaat untuk teman-teman, adik- adik atau yang lainya. Apabila ada yang tidak kalian pahami atau ingin bertanya lebih lanjut bisa isi dolom komentar, terimakasih.