Manfaat Belerang atau Sulfur Beserta Sifatnya – Materi yang akan di bahas kali ini adalah tentang belerang/sulfur. Belerang memiliki ciri khas yaitu bau yang sangat menyengat.
Pernahkah kalian mendatangi daerah wisata Dieng di Jawa Tengah? Atau daerah wisata Tangkuban Perahu di Jawa Barat? jika kalian pernah berkunjung ke salah satu tempat tersebut pasti kalian mencium bau menyengat, bukan? Nah bau menyengat tersebut merupakan bau dari belerang (sulfur). Yuuuk, lebih dalam lagi, perhatikan topik Manfaat Belerang atau Sulfur Beserta Sifatnya di bawah ini.
Sumber Belerang (S)
Belerang adalah unsur kimia dalam tabel periodik yang memiliki lambang S dengan nomor atom 16. Beleranga dihasilkan dari proses vulkanisme dengan bentuk nonmetal yang tak berasa, dan multivalensi.
Belerang dalam bentuk aslinya adalah sebuah zat padat kristalin kuning dengan sifat fisik berbentuk kristal berwarna kuning, kuning kegelapan, dan kehitam-hitaman karena pengaruh unsur pengotornya.
Unsur ini mempunyai berat jenis 2,05- 2,09 dan indeks kekerasan 1,5-2,5 (skala Mohs). Belerang memiliki sifat yang sama dengan oksigen antara lain, yaitu keduanya membentuk senyawa ionik dengan logam aktif, dan keduanya membentuk senyawa kovalen seperti H2S dan H2O, CS2 dan CO2, SCl2 dan Cl2O.
Perbedaannya terletak pada jari-jari atom elektonegativitas. Jari-jari atom O sebesar 0,73 A sementara jari-jari atom S adalah 1,04 A. Elektronegativitas O sebesar 3,5 sedangkan elektronegativitas S hanya sebesar 2,5.
Baca juga: Siklus daur karbon dan oksigen
Belerang terdapat secara luas di alam sebagai unsur bebas maupun senyawa, terutama di daerah pegunungan berapi, jika kalian pernah mengunjungi gunung berapi disitu kalian bisa merasakan adanya belerang di sekitar lingkungan dengan di tandai bau khas yang menyengat. Belerang terdapat dalam lapisan kurang lebih 150 m di bawah batu karang, basir, atau tanah liat, yang keberadaanya dalam bentuk senyawa H2S, SO2, CaSO4, dan MgSO4.
Belerang yanga ada dibawah tanah dicairkan dengan mengalirkan air yang sangat panas (campuran antara air dan uap air dengan tekanan sekitar 16 atm dan suhu sekitar 120o C) melalui pipa bagian luar dari suatu susunan tiga pipa konsentrik.
Belerang yang berbentuk cair (liquit) kemudian dipaksa keluar dengan memompakan udara panas (dengan tekanan sekitar 20-25 atm) setelah itu belerang dibiarkan dalam keadaan membeku.
Belerang yang diperoleh dengan cara ini mempunyai kemurnian yang hampir sempurna sampai 99,6% hal ini disebabkan karena belerang tidak larut dalam air.
Sifat-Sifat Belerang (S)
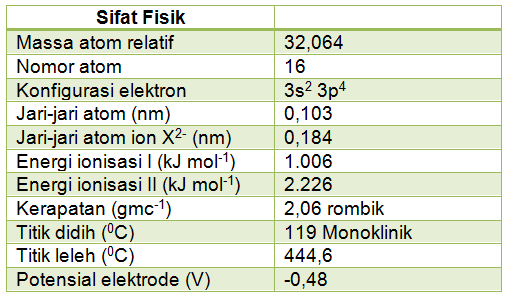
a. Sifat fisik belerang
Tabel sifat fisik belerang
b. Sifat Kimia Belerang
Belerang hanya memerlukan dua elektron lagi untuk mencapai konfigurasi s dari gas mulia. Belerang akan bertidak sebagai penerima elektron apabila bereaksi dengan logam, belerang juga merupakan unsur yang mudah bereaksi dengan semua unsur kecuali emas, platinum dan gas mulia.
Reaksi-reaksi pada belerang, antara lain seperti berikut.
- Dengan logam
Belerang bereaksi lebih kuat dengan logam.
Contoh: Fe(s) + S(s) → FeS(s)
- Reaksi dengan nonlogam
Belerang bereaksi dengan karbon panas membentuk karbon disulfida.
Contoh: C(s) + S (s) → CS (s)
Sifat kimia dari belerang adalah tidak larut dalam air atau H2SO4 memiliki titik lebur 129oCdan titik didihnya 446oC. Belerang mudah larut dalam CS2, CCl4, minyak bumi, minyak tanah, dan anilin. Merupakan penghantar panas dan listrik yang buruk dan apabila di bakar apinya berwarna biru dan menghasilkan gas-gas SO2 yang berbau busuk.
Pada suhu kamar, sulfur merupakan padatan yang lunak berwarna kuning terang. Pada dasarnya belerang tidak berbau namun bau yang melekat pada belerang disebabkan oleh hidrogen sulfida dan senyawa belerang organik. Sulfur di bakar dengan nyala biru memancarkan sulfur dioksida.
Sulfur tidak dapat larut dalam air tetapi dapat larut dalam karbon disulfida (CS2) dan dalam pelarut organik lain seperti benzena meskipun dengan kelarutan yang rendah. Keadaan oksidasi sulfur meliputi -2, +2, +4 dan +6. Sulfur membentuk senyawa yang stabil dengan semua unsur lain kecuali dengan gas mulia.
Belerang dapat mempunyai dua bentuk alotropi, yaitu belerang rombik dan belerang monoklinik. Belerang yang biasa kita lihat adalah belerang rombik dengan warna kuning, belerang ini stabil di bawah suhu 95,50C.
Bila lebih dari suhu 95,5oC, belerang rombik akan berubah menjadi belerang monoklinik yang akan mencair pada suhu 113oC. Biasanya belerang seringkali dijumpai dalam bentuk mineral sulfida dan sulfat, hidrogen sulfida, maupun senyawa belerang organik.
Pembuatan Unsur Dan Senyawa Belerang (S)
Adapun unsur dan senyawa belerang adalah sebagai berikut:
a. Senyawa SO2
Senyawa SO2 (sulfur dioksida) merupakan gas yang tidak berwarna, namun memiliki bau khas yang dapat membuat mata perih dan merusak saluran pernapasan. Senyawa SO2 terbentuk dari pembakaran batu bara yang mengandung belerang dan pemanggangan bijih sulfida.
- Pembakaran batu bara yang mengandung sulfida
S (s) + O2 (g) → SO2 (g)
- Pemanggangan bijih sulfida
2FeS2 (s) + O2 (g) → Fe2O2 (s) + 4SO2 (g)
Senyawa SO2 sangat larut dalam air, sehingga supaya tidak larut maka perlu dialirkan melalui kapur yang lembap. Dengan reaksi sebagai berikut:
CaCO3 (s) + SO2 (g) → CaSO3 (s) + CO2 (g)
b. Senyawa SO3
Senyawa SO3 adalah padatan yang mudah menguap, senyawa SO3 dibuat dengan cara oksidasi SO2 dengan oksigen secara spontan. Proses oksidasi ini berjalan sangat lambat karena SO2 sangat stabil. Untuk mempercepat proses oksidasi, tambahkan katalis vanadium (V) oksidasi ke dalamnya.
2 SO2 (g) + O2 (g) → 2SO3 (g) ∆H = -98 kJ mol-1
Kemudian menghasilkan SO3 yang bereaksi dengan air menghasikan H2SO4.
SO3 (g) + H2O (g) → H2SO4 (l) ∆H = -130 kJ mol-1
Asam sulfat banyak digunakan sebagai bahan dasar pembuatan pupuk (pupuk fosfat), cat, detergen, sabun, serta serat alami atau buatan.
Senyawa belerang secara garis besar dapat dibagi menjad senyawa belerang organik dan anorganik. Senyawa belerang anorganik di antaranya sebagai berikut:
- Sulfida (S2-), merupakan ion yang berasal dari kadmium sulfida (CdS).
- Sulfit (SO32-), garam asam sulfit (H2SO3) yang dihasilkan dengan cara melarutkan SO2 ke dalam air. Asam sulfat dan asam sulfit merupakan zat pereduksi yang kuat. Zat lain yang diturunkan dari SO2 meliputi pirolusit atau ion metabisulfit (S2O52-).
- Sulfat (SO42-), garam asam sulfat. Asam sulfat juga bereaksi dengan SO3 dalam perbandingan yang sama membentuk asam pirolusit (H2S2O7).
Manfaat Dan Dampak Belerang
a. Manfaat belerang
Unsur Belerang
Belerang merupakan unsur penting untuk kehidupan dan ditemukan dalam dua asam amino. Penggunaan pada umumnya terutama dalam fertilizer namun juga dalam bentuk mesiu, korek api, insektisida, dan fungisida.
Belerang banyak digunakan di bidang industri seperti: cat, kertas, plastik, bahan sintetis, minyak bumi,industri karet dan ban, belerang juga dapat dipakai sebagai obat pemberantas jamur dan untuk memasak getah karet dan getah perca.
Baca juga: Siklus daur belerang
Senyawa Belerang Dioksida
Kegunaan belerang dioksida adalah sebagai berikut:
- Sebagai bahan pengelantang untuk bulu domba, sutra, spons, domen, dan gula tebu.
- Sebagai bahan untuk membersihkan botol-botol dan bejana-bejana anggur.
- Sebagai bahan untuk memberantas penyakit pes di darat dan di kapal-kapal laut.
- Digunakan untuk memurnikan beberapa jenis minyak tanah.
Senyawa Asam Sulfat
Kegunaan dari asam sulfat antara lain sebagai berikut:
- Di laboratorium digunakan untuk pengering dan untuk kimia analisis.
- Dalam teknik industri digunakan sebagai bahan pupuk terutama pupuk fosfat; cat dan pigmen terutama dalam produksi titanium oksida; pembuatan asam (HCl, HNO, H3PO).
b. Kekurangan belerang
Senyawa belerang yang berdampak negatif antara lain:
- Hidrogen sulfida
Hidrogen sulfida merupakan gas sangat beracun yang mempunyai ciri khas seperti telur busuk, dalam jumlah banyak senyawa ini dapat menyebabkan kematian.
- Asam Sulfat (H2SO4)
Asam sulfat merupakan bisa menyebabkan kerusakan pada kulit karena megandung zat higroskopis.
- Belerang dioksida (SO2)
Belerang muda terbakar dan menghasilkan gas belerang dioksida, gas ini dapat menyebabkan sakit pada pernapasan dan menimbulkan gejala batuk. Dalam jumlah besar dapat merusak saluran paru-paru dan bahkan kematian. Pada tumbuhan gas ini menyebabkan noda coklat dan menggugurkan daun.
Baca juga: Siklus Biogeokimia
Demikian pembahasan kita pada materi Manfaat Belerang atau Sulfur Beserta Sifatnya ini, semoga tulisan ini bisa memberi manfaat untuk teman-teman, adik- adik atau yang lainya. Apabila ada yang tidak kalian pahami atau ingin bertanya lebih lanjut bisa isi dolom komentar, terimakasih. wassalam.
Referensi:
Lustiyati Deta E, dkk. (2009). Aktif Belajar Kimia Untuk SMA Dan MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Sukmawati Wening. (2009). Kimia Untuk SMA Dan Ma Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas XII Program Ilmu Alam. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Suwardi, dkk. (2009). Panduan Pembelajaran Kimia Untuk SMA/MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.