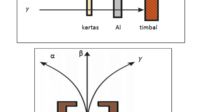
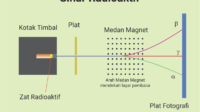
Kestabilan dan Ketidakstabilan Radioisotop – Pada mulanya penemuan keradioaktifan oleh Becquerel menunjukkan kelemahan dari teori atom Dalton tentang atom yang tidak dapat di bagi lagi.
Atom radioaktif mengalami perubahan drastis selama memancarkan radiasi, isotop tertentu yang dinamakan radioisotop, adalah radioaktif karena memiliki inti yang tidak stabil. Kestabilan ini tergantung perbandingan proton dengan neutron. Jika terlalu banyak atau terlalu sedikit neutron dapat mengakibatkan inti tidak stabil.
Suatu inti yang tidak stabil melepaskan energi dengan memancarkan radiasi selama proses peluruhan radioaktif. Inti yang tidak stabil tersebut pelan˗pelan mencapai keadaan yang lebih stabil bila ditransformasikan menjadi atom dari unsur yang berlainan. Peluruhan radioaktif dapat terjadi secara spontan dan tidak memerlukan sama sekali masukan energi.
Struktur Inti
Dalam inti atom terdapat proton dan neutron atau yang biasa disebut dengan nukleon (partikel penyusun inti). Nuklida didefinisikan sebagai suatu spesias tertentu, dalam suatu inti atom atau nuklida dapat di tandai dengan jumlah proton dan jumlah neutron. Secara umun inti atom di lambangkan dengan:
ZA X
dimana:
A= nomor massa = jumlah proton + jumlah neutron
Z = nomor atom = jumlah proton
Berdasarkan kesamaan dam nilai A,Z dan N, maka nuklida˗nuklida dapat digolongkan menjadi empat tipe, yaitu:
- Isotop: yaitu kelompok nuklida dengan nomor atom yang sama.
Contoh: 82204 Pb, 82206 Pb, 82207 Pb, 82208 Pb
Semuanya adalah isotop Pb dengan nomor atom = 82
- Ispbar: yaitu kelompok nuklida dengan nomor masa yang sama.
Contoh: 614C, 714N, 814O
Jumlah nukleon 14, atau nomor masa= 14
- Isoton: adalah kelompok nuklida dengan neutron sama, N sama. 13H dan 24H adalah isoton, masing˗masing mempunyai dua neutron atau N= 2.
- Isomer inti: nuklida dengan nomor masa dan nomor atom yang sama tetapi berbeda dalam tingkat energinya.
Kestabilan ini di tentukan oleh keseimbangan banyaknya proton dan neutron, karena neutron dalam inti berfungsi menjaga tolak menolak antar proton.
Untuk diketahui, pada unsur yang kecil jumlah neutron sama atau sedikit lebih banyak dari pada proton. Untuk unsur yang berat jumlah neutron lebih banyak dari pada jumlah proton.
Baca juga: Dampak sinar radiasi
Inti atom yang stabil adalah unsur Bismut atau Bi dengan nomor atom 83, sedangkan nuklida dengan nomor ataom (Z) > 83 tidak stabil. Berikut ini adalah gambar stabilitas inti sebagai pita kestabilan (stability belt):
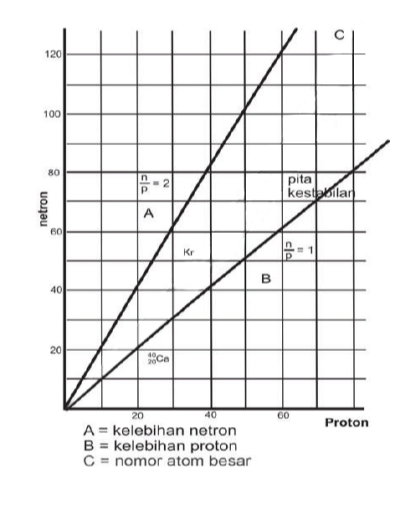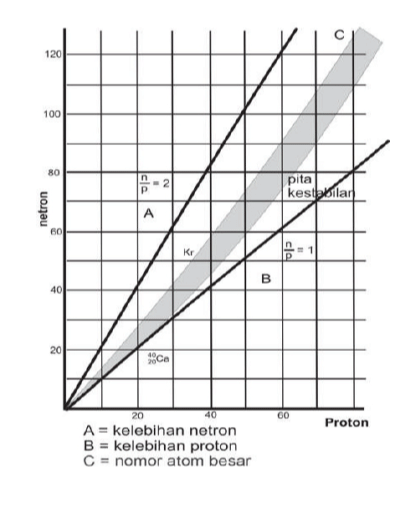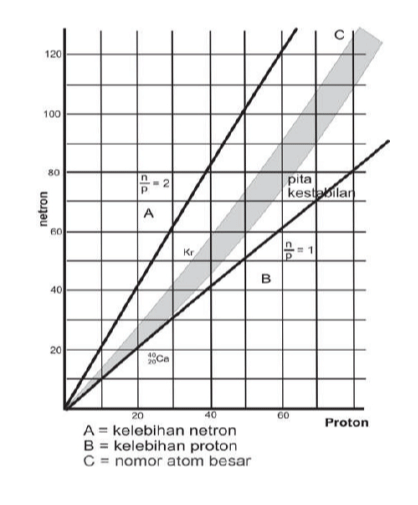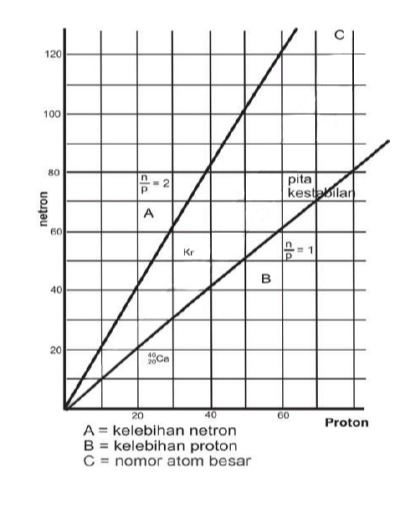
Sampai dengan nomor atom 80 inti inti stabil semakin besar dengan angka banding neutron dengan proton. Contoh pada atom 2040 Ca adalah inti stabil terberat yang angka banding neutron dan proton nya adalah 1.
Lalu inti yang tidak stabil (bersifat radioaktif) memiliki perbandingan n/p di luat pita kestabilan, yaitu:
- Di atas pita kestabilan
- Di bawah pita kestabilan
- Di seberang pita kestabilan
Inti yang tidak stabil aka mengalami peluruhan, peluruhan adalah proses perubahan dari inti yang tidak stabil menjadi inti yang lebih stabil. Inti atom yang terletak di atas pita kestabilan memiliki harga n/p terlalu besar (kelebihan neutron) akan mencapai kestabilan dengan cara:
- Memancarkan sinar β (elektron)
Pada proses ini terjadi perubahan neutron menjadi proton.
01n → 11p + ˗10e
Contoh:
614C → 714N + ˗10e
1635S → 1735Cl + ˗10e
55137Cs → 56137Ba + ˗10e
- Memancarkan neutron
Proses ini jarang di alam, hanya beberapa inti radioaktif yang dapat mengalami proses ini, diantranya:
25He → 25He + 01n
Inti yang terletak dibawah pita kestabilan memiliki harga n/p yang terlalu kecil atau mengalami kelebihan proton, akan mencapai kestabilan dengan cara:
- Memancarkan positron
Pada proses ini terjadi perubahan proton menjadi neutron.
11p → 01n + 10 e
Contoh:
611C → 511B + 10 e
- Memancarkan proton
Proses ini sangat jarang terjadi di alam.
Contoh:
1633S → 1532P + 11p
- Menangkap elekton
Elektron terdekat denganinti atom (elektron di kulit K ) di tangkap oleh inti atom sehingga terjadi perubahan 11p + ˗10 e → 01n
Contoh :
1940K + ˗10 e → 1840Ar
4290Mo + ˗10 e → 4190Nb
Baca juga: Manfaat radioisotop dalam kehidupan manusia
Macam˗macam nuklida
- Isotop: nuklida yang mempunyai jumlah proton yang sama tetapi jumlah neutron yang berbeda.
Contoh: 82206Pb dan 82206Pb
- Isobar: nuklida yang mempunyai jumlah proton dan neutron sama tetapi jumlah proton yag berbeda.
Contoh: 614C dan 714N
- Isoton: nuklida yang mempunyai jumlah neutron yang sama.
Contoh: 13H dan 24He
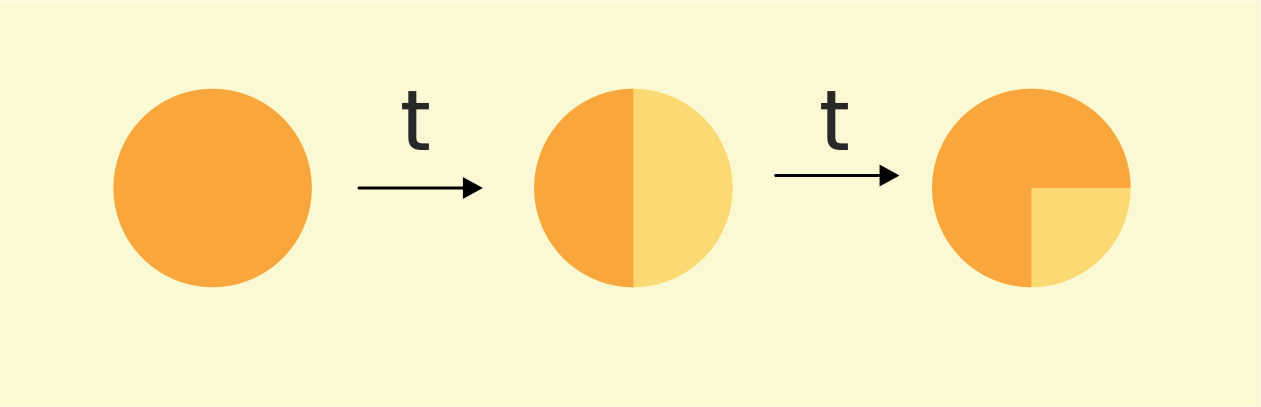
Kecepatan Peluruhan
Pada pembahasan sebelumnya, telah kita pelajari bersama bahwa nuklida yang tidak stabil akan mengalami peluruhan menjadi nuklida yang lebih stabil. Kecepatan peluruhan tiap nuklida berbeda˗beda tergantung jenis nuklidanya.
Bila di tinjau dari segi orde reaksi, peluruhan nuklida radioaktif mengikuti reaksi orde satu. Hal ini dapat kita gambarkan sebagai berikut:
Baca juga: Sinar radiasi alfa, beta dan gamma
Deret Keradioaktifan
Ciri-ciri yang dimiliki unsur radioaktif adalah dapat mengalami peluruhan dengan cara memancarkan sinar alfa, beta dan gamma yang dapat menghasilkan unsur baru yang pada umumnya juga bersifat radioaktif.
Unsur hasil dari transmutasi ini akan meluruh lebih lanjut sehingga terjadi deret peluruhan yang berakhir setelah berbentuk unsur stabil.
Ada empat deter keradioaktifan yang terdiri dari:
- Deret uranium dimulai dari 92238U dan berakhir menjadi 82206Pb
- Deret aktinium dimulai dari 90238U dan berakhir menjadi 82207Pb
- Deret thorium dimulai dari 92232Th dan berakhir menjadi 82208Pb
- Deret neptunium (buatan) dimuali dari 94242Pu dan berakhir menjadi 83209Bi
Berikut tabel Uranium:
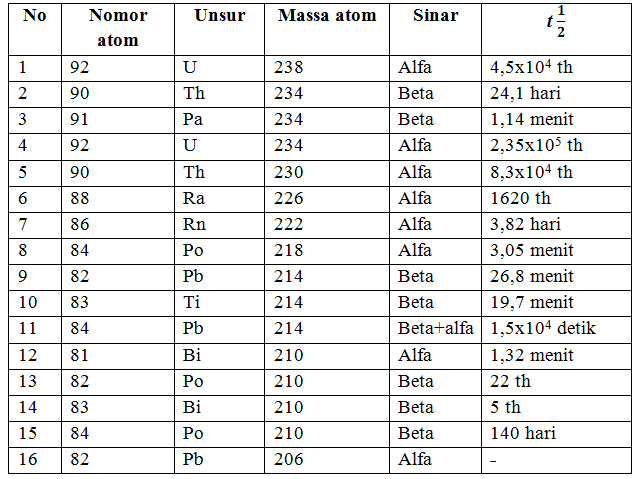
Dari tabel deret uranium di atas dapat ditulis secara singkat menjadi:
92238U → 82206Pb + 8 α + 6β
Demikian pembahasan kita pada Kestabilan dan Ketidakstabilan Radioisotop ini, semoga tulisan ini bisa memberi manfaat untuk teman-teman, adik- adik atau yang lainya.
Daftar Pustaka:
Sukmawati Wening. (2009). Kimia Untuk SMA Dan Ma Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas XII Program Ilmu Alam. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Suwardi, dkk. (2009). Panduan Pembelajaran Kimia Untuk SMA/MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Website: Kemendikbud.go.ig (diakses tanggal 26 Februari 2021)