Percobaan dan Contoh Soal Hukum Faraday – Pada pembehasan kali ini kita akan mempelajari tentang hukum Faraday, Faraday itu apa sih? seperti nama orang, iyaa beliau adalah seorang ahli kimia dari Inggris yang bernama Michael Faraday.
Faraday mengemukakan pernyataan yang menjadi hukum dasar dalam elektrokimia, beliau menemukan hubungan antara arus listrik dengan massa dalam suatu larutan tertentu, Ia menamakan larutan tersebut dengan elektrolit dan aliran listrik yang melalui larutan elektrolit disebut elektrolisis.
Dari pernyataan tersebut sampai saat ini di kenal dengan istilah Hukum 1 Faraday dan Hukum 2 Faraday. Pada tahun 1834, Michael Faraday mempelajari proses-proses reaksi dalam sel elektrokimia, khususnya dalam sel elektrolisis.
Percobaan dan Contoh Soal Hukum Faraday
A. Percobaan Michael Faraday
Pertama-tama yang dilakukan oleh Michael Faraday adalah melalukan penelitian hubungan antara besarnya arus yang mengalir dalam suatu elektrolisis dengan jumlah zat beraksi, untuk menggambarkannya diambil elektrolisis larutan perak nitrat (AgNO3). Pada katode akan terjadi reaksi reduksi seperti berikut:
Ag+(aq) + e– → Ag(s)
Dari reaski di atas dapat dikatakan bahwa untuk menghasilkan 1 mol logam Ag, diperlukan 1 mol elektron. Jumlah listrik yang dialirkan ke dalam sel elektrolisis untuk mendapatkan 1 mol elektron dinamakan hukum 1 faraday.
Berdasarkan percobaan diperoleh bahwa 1 mol elektron mengandung muatan listrik sebesar 96500 Coulomb atau 1 mol elektron = 1 Faraday = 96500 Coulomb
Pada tahun 1832 Faraday mengemukakan dua hukum yang penting sebagai hasil dari percobaannya tentang hubungan antara arus listrik dengan jumlah zat yang terbentuk pada elektrode yaitu hukum 1 Faraday dan hukum 2 Fararday.

B. Pengertian Hukum Faraday dan Bunyi Hukum Faraday
Hukum Faraday adalah hukum dasar elektromagnetis yang menjelaskan tentang arus listrik yang menghasilkan medan magnet dan sebaliknya tentang medan magnet yang dapat menghasilkan arus listrik pada sebuah konduktor.
Berdasarkan hukum Faraday inilah yang menjadi dasar dari prinsip kerja induktor, transformator, selenoid, generator listrik dan motor listrik.
Baca juga: Metode lumpur aktif
Hukum Faraday 1
Massa zat yang dibebaskan pada suatu elektrolisis berbanding lurus dengan jumlah listrik yang mengalir disebut sebagai Hukum Faraday 1. Secara sistematis dapat ditulis sebagai berikut:
G ≈ Q
Keterangan:
G = massa zat yang dibebaskan (gram)
Q = jumlah listrik yang digunakan (Coulomb)
Namun, apabila jumlah muatan listrik merupakan hasil kali kuat arus (I) dengan waktu (t), maka persamaan di atas dapat di tulis sebagai berikut:
G = I . t
Seperti yang kita ketahui bahwa dalam reaksi elektrolisis di katode terjadi reaksi reduksi dengan persamaan:
L n+ (aq) + n e– → L (s)
Untuk mendapatkan 1 mol L diperlukan sejumlah n mol elektron. Oleh karena itu, untuk mendapatkan sejumlah logam maka jumlah listrik yang dipergunakan adalah.
Q = n (e–) x F
Keterangan:
F = Konstanta Faraday (96.500 C/mol)
n (e–) = Mol eletkron
Contoh soal hukum Faraday 1
Dalam suatu sel elektrolisis larutan CuSO4 dengan arus listrik sebesar 1,5 A selama 2 jam. Tentukan massa tembaga yang diendapkan!
Penyaelesaian:
Pada katode terjadi reaksi reduksi ion Cu2+ menjadi Cu dengan ‘setengah reaksi’ sebagai berikut = Katode : Cu2+ (aq) + 2e– → Cu (s)
Dari setengah reaksi di atas diketahui:
1 mol Cu ∞ 2 mol e–
1 mol Cu ∞ 2 F, Karena 1 F = 1 Mol e–
1 F = 6,02217 x 1023 e –
1 F = 6,02217 x 1023 e – x 1,60218 x 10-19 Ce -1
1F = 96486,00331 C
1 F = 96500 C
Jadi, 1 mol Cu ∞ 2 x 96500 C
1 C = { (1 mol Cu/(2 x 96500)) x Ar Cu g mol–} g
Arus listrik sebesar 1,5 A dialirkan ke dalam sel elektrolisis selama 2 jam menghasilkan massa Cu sebanyak:
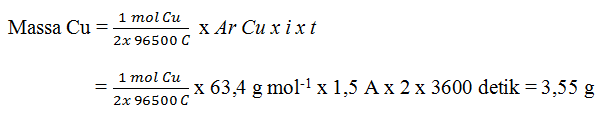
Jadi, massa Cu yang dihasilkan pada katode sebanyak 3,55 gram.
Hukum Faraday 2
Zat yang dibebaskan dalam elektrolisis berbanding lurus dengan massa ekuivalen nya disebut dengan Hukum Faraday 2. Secara sistematis, secara sistematis pernyataan tersebut dapat dituliskan seperti berikut.
G ≈ Me
Jika ada arus listrik yang sama dialirkan dalam dua buah sel elektrolisis yang berbeda maka perbandingan massa zat yang dibebaskan akan sama dengan perbandingan massa ekuivalennya.
Sekarang kita gabungkan dengan pernyataan hukum Faraday 2 yang menyatakan massa zat terendapkan hasil dua buah elektrolisis dengan arus listrik yang sama secara matematis dapat dituliskan seperti berikut.
G1/Me1 = G2/Me2
Keterangan:
G = massa hasil elektrolisis (gram)
Me = massa ekuivalen
Baca juga: Contoh soal Mol
Contoh soal Hukum Faraday 2
Dua buah elektrolisis, dengan sejumlah arus tertentu dalam waktu 2 jam dibebaskan 0,504 gram gas hidrogen (Ar H = 1). Hitunglah banyaknya gas oksigen yang dapat dibebaskan oleh arus yang sama dalam waktu yang sama. (Ar = 16)!
Penyelesaian :
Diketahui:
GH2 = 0,504 gram
MeH2 = 1/1 = 1
MeO2 = 16/2 = 8
Ditanya : GO2 ..?
Jawab :
G1/Me1 = G2/Me2
0,504 gram/GO2 gram= 1/8
GO2 = 4,032 gram
3. Aplikasi sel elektrolisis
Proses elektrokimia dalam sel elektrolisis sangat dibutuhkan dalam bidang industri, khususnya dalam pembuatan zat kimia, pemurnian logam dan penyepuhan logam. Nah, sekarang kita akan menyinggung sedikit tentang proses elektokimia dalam sel elektrolisis pada 3 bidang tersebut.
Pembuatan zat kimia
Ada beberapa zat kimia yang dapat diperoleh melalui proses elektrokimia dalam sel elektrolisis, sehingga beberapa sel elektrolisis banyak digunakan dalam industri kimia.
Produksi gas oksigen dan gas hidrogen
Dalam reaksi sel elektolisis, gas oksigen dapat kita peroleh dari reaksi oksidasi H2O dan gas hidrogen melalui reaksi reduksi H2O. Reaksi oksidasi H2O terjadi pada anion yang mengandung oksigen seperti NO3–, CO32-, SO42-, dan reaksi reduksi H2O terjadi pada kation yang berasal dari unsur golongan utama.
Jadi gas hidrogen dan gas oksigen dapat terbentuk melalui reaksi elektrolisis pada senyawa yang mengandung kation unsur golongan utama dan anion yang mengandung oksigen dengan elektrode inert.
Reaksi elektrolisis yang menghasilkan gas oksigen dan hidrogen misalnya elektrolisis larutan KOH dengan elektrode karbon melalui reaksi:
….. (aq) → K+ (aq) + OH– (aq)
Katode : 2H2O (l) + 2e– → 2H2O– (aq) + H2 (g)
Anode : 2H2O (l) → 4H+ (aq) + O2 (g) + 4e–
Pada reaksi elektrolisis larutan elektrolit yang digunakan, yaitu KOH berfungsi sebagai penghantar listrik dan air merupakan zat pereaksi utama pada katode dan anode.
Produksi gas klorin
Klorin merupakan bahan industri utam yang diproduksi melalui elektrolisis larutan garam pekat NaCl yang disebut ‘brine’ dengan reaksi sebagai berikut:
NaCl (aq) → Na+ (aq) + Cl– (aq)
Katode : 2 H2O(l) + 2 e– → 2 OH–(aq) + H2(g)
Anode : 2 Cl– (aq) → Cl2(g) + 2 e–
Ion OH– yang terbentuk pada katode bergabung dengan ion Na+ hasil disosiasi NaCl membentuk NaOH.
Produksi logam aluminium
Produksi logam dalam proses elektrolisis pada umumnya dalam bentuk lelehannya. Bahan mentah untuk memproduksi logam alumnium adalah bauksit, yaitu mineral aluminum terhidrat, misalnya Al2O3, H2O dan Al2O3, 2H2O. Adapun proses elektrolisis yang digunakan untuk memperoleh logam murni dari mineralnya dapat disebut elektrometalurgi.
Pemurnian logam
Proses pemurnian logam (refining) banyak digunakan dalam industri, misalnya pemurnian logam tembaga. Penggunaan logam tembaga sebagai konduktor, misalnya pada kabel listrik perlu memperhatikan kemurnian tembaga yang digunakan, semakin murni tembaganya maka semakin tinggi konduktivitasnya.
Pengotor yang terdapat pada tembaga antara lain, besi, seng, platina, perak dan emas. Pada pemurniannya tembaga dengan elektrolisis, katode berupa tembaga kotor dan anode berupa tembaga murni. Larutan elektrolit yang digunakan mengandung kation logam yang akan dimurnikan, seperti CuSO4, dengan reaksi sebagai berikut:
CuSO4 (aq) → Cu2+ (aq) + SO42- (aq)
Katode : Cu2+ (aq) + 2 e– → Cu(s)
Anode : Cu(s) → Cu2+ (aq) + 2 e–
Penyepuhan logam
Penyepuhan logam (elektroplating) banyak digunakan untuk melindungi barang-barang logam terhadap korosi dan memperindah penampilan. Misalnya melapisi alat makan, seperti sendok atau teko teh dengan perak agar nampak lebih menarik, melapisi mesin kendaraan bermotor yang terbuat dari baja dengan kromium dan melapisi kerangka sepeda dengan titanium oksida agar terhindar dari korosi.
Proses penyepuhan logam dengan cara elektrolisis, yaitu memperhatikan logam yang akan disepuh sebagai katode dan logam penyepuh sebagai anode.
Elektrolisis yang digunakan mengandung katio logam peyepuh, nih contoh sederhananya, misalnya kalian ingin menyepuh kunci dengan tembaga, maka kunci berfungsi sebagai katode danlogam tembaga (Cu) sebagai anode, elektrolisis yang digunakan mengandung ion Cu2+ misalnya CuSO4.
Semoga artikel di atas dapat membantu teman-teman dalam memahami dan mengaplikasikan hukum Faraday 1 dan hukum Faraday 2 dalam mengerjakan soal-soal dan latihan.
Baca juga: Reaksi oksidasi dan reduksi
Demikian pembahasan Percobaan dan Contoh Soal Hukum Faraday kali ini, jika ada yang kurang dimengerti bisa komentar di kolom komentar yaa, terimakasih
Referensi:
Lestiyati D Alisabeth, dkk. (2009). Aktif Belajar Kimia Untuk SMA Dan MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Sukmanawati Wening, dkk. (2009). Kimia Untuk SMA Dan MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.