Proses Korosi Pada Logam – Pada pembahasan kali ini materi yang akan kita bahas adalah korosi atau pengkaratan pada besi, adapun poin yang akan dibahas adalah pengertian korosi, proses terjadinya korosi, dampak kerugian korosi, dan cara pencegahan korosi.
Agak berat yaa pembahasan Proses Korosi Pada Logam ini ya?, tapi Insayaallah dengan penjelasan di bawah ini akan membantu teman-teman atau adik-adik dalam memahami materi pelajran atau mata kuliah yang ada di sekolah dan di kampus kalian.
A. Pengertian Korosi
Korosi merupakan kata yang akrab kita dengar sehari-hari, korosi selalu berhubungan dengan besi dan logam. Korosi dapat di artikan sebagai serangan kimia pada suatu logam oleh lingkungannya. Korosi adalah bentuk kerusakan logam yang disebabkan oleh proses elektrokimia.
Pada hakikatnya korosi adalah suatu reaksi dimana suatu logam dioksidasi, hasil dari oksidasi tersebut menyebabkan suatu logam menjadi berkarat. Jadi tidak selamanya reaksi oksidasi-reduksi itu menguntungkan.
Aku kasih contoh salah satu bentuk korosi pada logam. Coba kalian perhatikan barang atau alat yang berbentuk logam di sekitar kalian, ada yang berkarat? Umumnya korosi terjadi pada permukaan besi dengan bentuk karatan.
Karat merupkan lapis tipis yang berwarna coklat kemerahan pada permukaan logam atau besi. Banyak di temukan di lingkunagn sekitar kita contoh dari korosi salah satunya adalah karatan pada pagar dengan lapisan cat yang telah terkelupas, sendok nasi, panci, pisau dan lain lain ditandai dengan munculnya karat berwarna kuning. Umumnya banyak kita temukan sebagai peralatan dapur.
B. Proses Terjadinya Korosi
Sekarang pertanyaan selanjutnya, bagaimana proses pengkaratan itu terjadi ? Proses timbulnya karat semakin cepat terjadi jika logam tersebut ditempatkan pada lingkungan yang memiliki kelembapan udara tinggi atau sering terkena air hujan.
Pengkaratan terjadi apabila ada kontak langsung antara logam dengan oksigen dan air. Besi merupakan logam yang paling mudah mengalami reaksi oksidasi dan air. Berikut merupakan reaski logam besi dalam udara lembap:
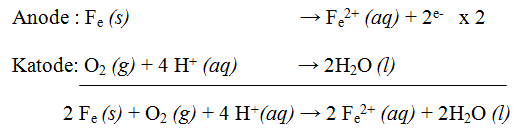
Apabila korosi terjadi pada suasana basa, maka reaksi yang terjadi pada katode adalah:
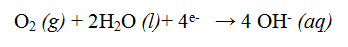
Pada suasana asam ion H+ dapat diperoleh dari reaksi antara karbon dioksida dengan air membentuk H2CO2- Ion Fe2+ yang terbentuk pada anode teroksidasi lebih lanjut oleh oksigen membentuk besi (III) oksida, dengan reaksi:
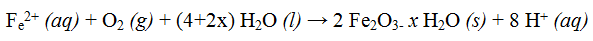
Fe2+ yang dihasilkan berangsur-angsur akan dioksidasi membentuk Fe3+. Sedangkan pada ion OH– akan bergabung dengan elektrolit yang ada di alam atau dengan ion H+ dari terlarutnya oksida asam (SO2, NO2) yang dihasilkan dari curahan air hujan.
Baca juga: Hukum Faraday beserta contoh soalnya
Bedasarkan hasil reaksi di atas akan dihasilkan karat dengan rumus senyawa Fe2O3 xH2O. Karat ini biasa dikenal dengan sifat katalis untuk proses perkaratan berikutnya yang disebut autokatalis.
Proses elektrokimia dalam pembentukan karat pada logam besi dapat di jelaskan sebagai berikut:
Proses elektrokimia dalam pembentukan karat pada logam besi dapat di jelaskan sebagi berikut:
- Logam besi mengalami kontak dengan udara dan mengalami oksidasi menjadi Fe2+ dan larut dalam air pada lapisan besi. Daerah tempat oksidasi logam Fe disebut daerah anode.
- Ion Fe2+ bergerak menuju katode dalam tetesan air dan elektron yang dibebaskan oleh logam besi yang teroksidasi bergerak menuju katode melalui logam.
- Oksigen dalam udara mengalami reaski reduksi dengan menangkap elektron yang dibebaskan oleh logam besi membentuk H2O. Daerah tempat terjadinya reaksi reduksi oksigen disebut daerah katode.
- Sebagian oksigen larut dalam air dan mengoksidasi Fe2+ menjadi Fe3+ membentuk hidrat besi (III) ksida, Fe2O2.xH2O (karat).
C. Dampak Kerugian Akibat Adanya Korosi
Korosi menimbulkan banyak kerusakan, terutama pada bangunan dan benda-benda pada bangunan yang terbuat dari besi. Mengapa hal tersebut dapat terjadi? korosi merupakan reaksi yang cept terjadi dan berlangsung secara terus menerus karena pada besi (III) oksida bersifat porous (mudah ditembus oleh oksigen dan air). Sifat porous pada besi dapat mempercepat proses pengkaratan selanjutnya. Sehingga bangunan atau benda-benda yang telah berkarat semakin rapuh.
Perlu kalian ketahui karat yang dihasilkan dari korosi besi semakin berbahaya karena mudah larut dan bersifat racun. Hal tersebut sangat berbahaya bagi industri makanan, obat-obatan dan zat kimia yang menggunakan peralatan industri yang terbuat dari besi.
Pada dasarnya besi yang terkena korosi akan bersifat rapuh dan tidak ada kekuatan. Ini sangat membahayakan kalau besi tersebut digunakan sebagai pondasi bangunan atau jembatan. Alat-alat yang mengandung senyawa karat juga membahayakan kesehatan, sehingga besi tidak bisa digunakan sebagai alat-alat masak, alat-alat industri makanan/farmasi/kimia.
Baca juga: Reaksi oksidasi dan reduksi
D. Cara Pencegahan Korosi Pada Logam
Pencegahan korosi dapat menghindari kerugian yang ditimbulkan oleh korosi. Bagaimana cara mencegah korosi? Untuk melindungi besi dari karat, kita dapat memanfaatkan reaksi reduksi oksidasi. Perlindungan ini dapat dilakukan dengan beberapa cara, antara lain seperti berikut.
1. Penggunaan logam pelapis
Prinsip dasar cara iniadalah mengindari reaksi antara besi dengan oksigen dan air. Logam pelapis yang biasa digunakan sebagai pelindung korosi pada pembuatan kaleng. Misalnya timah, tembaga, atau platina. Pada cara ini logam pelapis yang akan digunakan memiliki potensial elektrode strandar lebih positif daripada yang dilapisi.
Timah dapat digunakan sebagai logam pelapis besi dengan nilai Eo=-0,44 V karena timah merupakan logam yang tidak mudah teroksidasi sehingga besi akan terhindar dari korosi.
Kelemahan dari cara ini adalah apabila logam pelapis rusak, maka korosi pada besi akan semakin cept tejadi. Hal tersebut dikarenakan oleh terbentuknya sel elektrokimia dengan besi sebagai anode dan logam pelapis sebagai katode yang akan menghasilkan karat ada besi.
2. Perlindungan katode
Prinsip perlindungan besi dari korosi yaitu dengan cara menghubungkan besi dengan logam lain yang lebih mudah dioksidasi atau logam yang memiliki potensia elektrode standar lebih kecil daripada besi. Misalnya logam besi yang dihubungkan dengan logam magnesium akan lebih sukar mengalami korosi.
3. Galvanisasi
Galvanisasi merupakan pelapisan dengan zink. Oleh karena potensial elektrode besi lebih negatif daripada zink maka besi bertindak sebagai katode dan zink mengalami oksidasi.
4. Cromium Plating
Cromium plating merupakan pelapisan dengan kromium. Pelapisan ini menjadikan logam mengilap.
Baca juga: Metode lumpur aktif
5. Sacrificial Protection
Perlindungan ini disebut juga pengorbanan anode, karena logam pelapisnya yaitu magnesium lebih mudah berkarat daripada besi. Oleh karena itu, jika magnesium dikontakkan dengan besi maka besi tidak berkarat sedangkan yang berkarat adalah magnesium.
Demikian pembahasan kita pada materi Proses Korosi Pada Logam ini, semoga tulisan ini bisa memberi manfaat untuk teman-teman, adik- adik atau yang lainya. Apabila ada yang tidak kalian pahami atau ingin bertanya lebih lanjut bisa isi dolom komentar, terimakasih. wassalam