Kegunaan dan Sifat Haloalkana – Pada pembahasan kali ini kita akan belajar tentang senyawa turunan alakana, terdapat banyak sekali senyawa turunan alkana seperti, alakan (eter), alkanol (alkohol), alkanal (aldehida), alkanon (keton), akanoat (asam karboksilat), dan alkil alkanoat (ester).
Namun pada pembahasan ini ( Kegunaan dan Sifat Haloalkana ) kita hanya fokus pada poiin haloalkana, tentang stukturnya, penamaan dan penomorannya, sifat komia dan sifat fisik hakoalkana serta kegunaanya dalam kehidupan sehari˗hari.
Baca juga: Tata nama alkohol dan kegunaannya
Haloalkana biasa disebut dengan alkilhalida adalah senyawa organik yang mengandung flour, klor, brom, atau iod yang terikat secara kovalen dengan rumus senyawa R˗X.

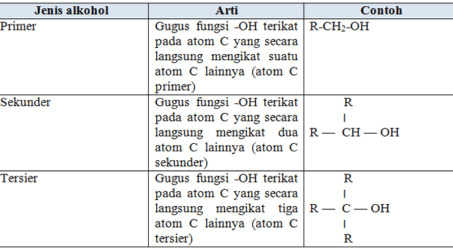
Stuktur Haloalkana
Senyawa haloalkana dianggap berasal dari alkana dengan mengganti atom hidrogen dengan atom halogen. Turunan monohalogen dikenal sebagai alkil halida.
Perhatikan contoh penulisan struktur haloalkana berikut,
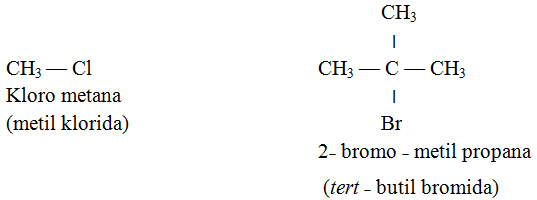
Tata nama Haloalkana
Penulisan nama haloalkana dapat mengikuti dua cara, yaitu cara IUPAC dan cara umum.
a. Nama IUPAC (haloalkana)
Menurut cara IUPAC, haloalkana dianggap sebagai turunan alkana, sedangkan atom hidrogen dianggap sebagai gugus pengganti. Rantai pokok dipilih rantai terpanjang yang mengandung atom halogen.
Penomorannya dapat dimulai dari salah satu ujung rantai sedemikian sehingga posisi atom halogen mendapat nomor yang paling kecil. Jika terdapat lebih dari satu jenis halogen, maka prioritas penomoran didasarkan pada kereaktifan halogen halogen dengan urutan F > Cl > Br > I.
b. Nama Trivial (umum)
Nama haloalkana terdiri dari dua bagian. Bagian pertama adalah gugus alkil, seperti metil atau etil sedangkan bagian kedua berupa nama halogen yang diberi akhiran ˗ida. Contoh: Metil klorida, CH3Cl.
Perhatikan, bahwa ikatan dalam haloalkana adalah kovalen, bukan ionik. Berdasarkan nama trival, haloalkana dengan suatu halogen (X) terikat pada karbon rantai lurus disebut alkali halida.
Adapun contoh nama IUPAC dan nama trivial haloalkana berikut ini:

Penomoran dapat dimulai dari atom F karena ataom F paling reaktif, kemudian Cl dan terakhir Br. Penulisan disusun menurut abjad, mulai dari bromo (berawal huruf b), kemudian kloro (berasal dari chloro yang berawal dari huru c) selanjutnya flouro dan yang terakhir gugus metil.
Sifat˗sifat haloalkana
1. Sifat kimia
Sifat kimia yang khas bagi senyawa haloalkana dapat dilihat dari reaksi penggantian atom halogen yang reaktif dengan atom gugus monovalen lain. Iodida lebih reaktif daripada bromida sedangkan bromida lebih reaktif daripada klorida. Contoh reaksi˗reaksi yang melibatkan haloalkana, yaitu:
a. Hidrolisis
Dalam senyawa alkil halida dapat terhidrolisis dengan lambat dalam air yang mendidih tetapi akan terhidrolisis dengan cepat dalam larutan alkalis panas, kemudian akan menghasilkan alkohol. Reaksinya sebagai berikut.
C2H5Br + NaOH → C2H5OH + NaBr
Etil alkohol
b. Reaksi dengan kalium sianida
Bila alkil halida dididihkan dengan larutan kalium sianida (pelarut alkohol), maka yang terbentuk adalah alkil sianida. Contoh:
C2H5Br + KCN → C2H5CN + KBr
Etil sianida
c. Reaksi dengan amonia
Amonia dalam larutan berair yang pekat bereaksi dengan alkil halida menghasilkan garam amin primer. Contoh
C2H5Br + NH3 → C2H5NH3Br
Etilamin hidrobromida
2. Sifat fisik
Untuk menjelaskan sifat fisik dari alkil halida perhatikan tabel dibawah ini:
Tabel 1. Alkil halida sederhana
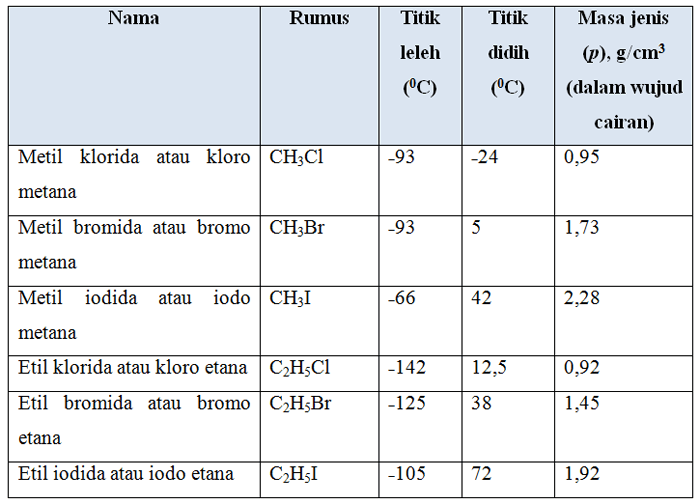
sifat˗sifat fisik halida sederhana diberikan dalamtabel di atas, pada tabel tersebut jelas bahwa metil klorida, metil bromida dan etil klorida adalah gas pada suhu kamar sedangkan yang lain berupa cairan.
Baca juga: Reaksi asam basa
Alkil halida terasa manis dan semua tak berwarna bila murni, meskipun alkil halida cenderung berubah menjadi kuning bila terkena sinar matahari dalam waktu yang lama.
Alkil halida praktis tak dapat bercampur dengan air, membentuk lapisan terpisah bila dicampur dan emulsi bila dikocok, tetapi larutan dengan cepat daam alkohol dan eter.
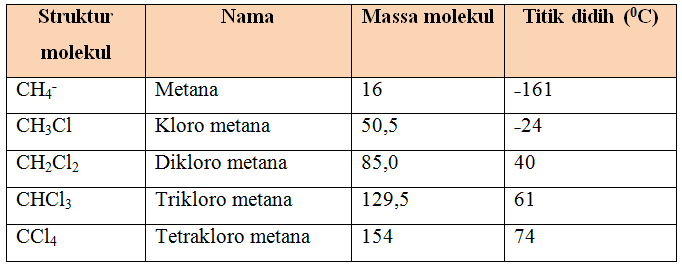
Senyawa yang terhalogenasi banyak memiliki titik didih lebih tinggi, seperti terlihat untuk klorometana dalam tabel di bawah ini.
Tabel 2. Massa molekul dan titik didih klorometana
Kegunaan haloalkana
Seperti halnya yang lain, haloalkana juga memiliki banyak kegunaan, berikit inimkita akan membahas contoh haloalkana dan kegunaannya.
- Metil klorida dan metil bromida
Metil klorida dapat digunakan di bidang industri sebagai refrigerant (pendingin) dan agen metilasi, yaitu dalam industri silikon dan pewarna. Metil bromida digunakan sebagai pemadam api pesawat terbang dan pengasapan hama buah˗buahan.
- Etil klorida
Etil klorida digunakan pada skala besar untuk pembuatan tetraetil timbal (C2H5)4Pb, dari paduan natrium˗timbal (Na4Pb). Reaksinya:
4C2H3Cl (aq) + Na4Pb (s) → (C2H3)4Pb (s) + 4 NaCl (aq)
Etil klorida juga digunakan sebagai anestesi lokal dalam operasi kecil karena efek dingi bila menguap pada kulit dan yang paling penting untung untuk pembuatan plastik etil selulosa.
- Kloroform (CHCl3) dan iodoform (CHI3)
Kloroform merupakan zat pembius yang kuat, tetapi penggunaannya dapat merusak hati. Haloalkana yang lebih baik sebagai pembius adalah 2˗ bromo˗2 kloro ˗1,1,1 trifluoroetana (CF3˗CHClBr). Iodoform digunakan sebagai antiseptik pada pengobatan luka.
- Freon
Feon merupakan nama dagang Dupont untuk senyawa terfluoronasi. Zat ini digunaka sebagai refrigerant (cairan pendingin). Freon 12 (diklorodifluorometana) dan freon 11 (triklorofluorometana) tidak beracun, tidak berbau, dan tidak mudah terbakar. Sebagian digunakan dalam pemadam kebakaran. Penggunaan freon telah banyak dikurangi dan bahkan dihentikan karena freon dapat merusak lapisan ozon di stratosfer.
- DDT (diklorodifenitrikloroetana)
DDT digunakan secara luas sebagai insektisida mulai tahun 1950 sampai 1970. Penggunaanya dibatasi karena tak terurai di lingkungan dan dapat masuk ke dalam rantai makanan.
- Tertraklorometana (CCl4)
Zat ini digunakan terutama sebagai pelarut zat organik dan bahan pembuatan senyawa senyawa yang mengandung flour.
Semoga artikel Kegunaan dan Sifat Haloalkana di atas dapat membantu teman-teman dalam memahami dan mengetahui senyawa turunan alkana, khususnya haloalkana. Demikian pembehasan kita kali ini, jika ada yang kurang dimengerti bisa komentar di kolom komentar yaa, terima kasih.
Daftar Pustaka:
Soebiyanto Suwardi, Dkk. (2009). Panduan Pembelajaran Kimia kelas 12. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta