Mengenal Perkembangan Teori-Teori Atom
Teori-Teori Atom – Suatu unsur bisa dibagi-bagi menjadi bagian terkecil yang disebut atom. Atom ini memiliki sifat yang sama dengan bagian lainnya dalam unsur yang sama dan tidak bisa dibagi lagi. Sebagai contoh, atom emas berbeda dengan atom perak. Lalu bagaimana cara untuk membedakannya?
Teori Awal tentang Atom
Di abad 5 SM, Democritus, filsuf terkenal dari Yunani mengemukakan bahwa seluruh zat atau materi tersusun dari partikel-partikel yang sangat kecil. Selain itu ia menjelaskan bahwa partikel tidak bisa dibagi lagi atau disebut atomos. Kemudian John Dalton (1766-1844) membuat definisi “atom”. Teorinya yang sangat terkenal yang menjadi dasar perkembangan kimia modern adalah sebagai berikut.
• Unsur terdiri dari partikel sangat kecil yang tidak bisa dibagi lagi, atau disebut “atom”
• Atom yang menyusun unsur bersifat indentik sedangkan atom penyusun unsur lain bersifat berbeda.
• Senyawa tersusun oleh atom-atom yang terdiri dari 2 unsur atau lebih. Perbandingannya pun tertentu dan tetap.
• Atom-atom tersebut tidak bisa diciptakan maupun dimusnahkan.
Struktur dan Pekembangan Model Atom
1. Penemuan Elektron
Penemuan elektron didasari oleh penemuan tabung sinar katoda oleh Karl Ferdinan Braun yang disempurnakan oleh Sir William Crookes. Kemudian pada tahun 1879 JJ. Thomson menemukan bahwasinar katoda adalah materi berukuran amat kecil dan dapat memutar baling-baling yang dipasang tepat di antara katoda dan anoda.
Dari penyelidikannya, JJ. Thomson bisa menentukan muatan elektron sebesar 1,76×108 coloumb/gram. Kemudian Millikan menyempurnakannya dan mendapati bahwa muatan elektron adalah sebesar 1,6022×10-19 C dan dihitung masa 1 elektron sebesar 9,1×10-28 gram.
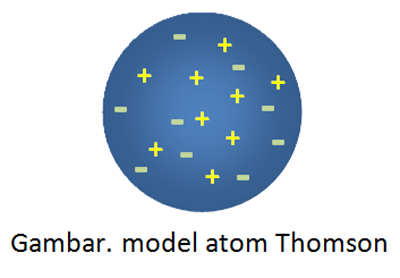
Dari percobaan Thomson, ia menyimpulkan bahwa sinar katoda adalah penyusun atom. Teorinya model atomnya yang terkenal yaitu roti kismis, dimana mewakili bentuk atom sebagai bola pejal bermuatan positif yang didalamnya tersebar muatan negatif elektron.
2. Penemuan Inti Atom dan Proton
Eugene Goldstein di tahun 1886 memodifikasi tabung sinar katoda dan ditemukan bahwa terdapat sinar yang arahnya berlawanan dengan sinar katoda dan menembus lubang katoda (sinar kanal). Wilhelm Wien kemudian menjelaskan bahwa sinar tersebut adalah proton karena bermuatan positif. Lalu Ernest Rutherford melakukan percobaan mengenai hamburan sinar alfa terhadap sebuah lempengan emas yang tipis.
Kesimpulan yang didapat dari percobaan ini yaitu:
• Hampir seluruh partikel α diteruskan. Artinya atom bukanlah bola pejal tetapi sebagian meruakan ruangan kosong (hampa).
• Jika lempengan emas adalah lapisan atom-atom emas, maka didalamnya ada partikel kecil yang memiliki muatan positif.
• Partikel tersebut merupakan penyusun inti atom. 1 dari 20.000 partikel α dibelokkan. Jika dibandingan dengan diameter maka didapatkan bahwa ukuran inti kurang lebih 10.000 lebih kecil dari ukuran atom secara keseluruhan.
Kesimpulan diatas kemudian membawa Rutherford pada pemikiran tentang model atom yang dikenal sebagai model atom Rutherford. Ia mengemukakan bahwa inti atom berada di tengah sedangkan elektron mengelilinginya.
Baca juga: Partikel Penyusun Atom
3. Neutron
James Cadwick (1932) membuktikan kebenaran adanya partikel lain di dalam ini atom berdasarkan percobaan hamburan partikel α terhadap parafin serta boron. Dari percobaan didapat bahwa adanya pancaran sinar mirip dengan gelombang elektromagnetik yang tidak dibelokkan oleh medan magnet/listrik. Selain itu ditemukan juga bahwa sinar ini bersifat netral yang kemudian diberi nama neutron.
4. Model Atom Niels Bohr
Kelemahan model atom Rutherford kemudian mendorong Niels Bohr untuk menemukan model atom yang terbaik. Melalui percobaan spektrum hidrogen didapatkan bahwa elektron mengelilingi inti dalam orbitnya dengan energi yang konstan sehingga tidak jatuh ke inti. Elektron juga dapat berpindah lintasan dan memancarkan energi.
Selain artikel berjudul teori-teori atom di atas, Anda juga bisa membaca artikel serupa yang berjudul perkembangan teori atom.
Referensi :
Brady, James E. 1990. General Chemistry, (Principles & Structures). New York: John Wiley and Sons.
Chang, R. 2005. Chemistry. 8th ed. New York: Mc-Graw Hill.
Keenan, Charles E. et. al, – Pudjaatmaka. 1999. Ilmu Kimia Universitas (terjemahan). Jakarta: Erlangga.