Contoh, Sifat dan Kegunaan Benzena – Istilah benzena mungkin sangat asing bagi kita, atau jarang sekali kita dengar di kehidupan sehari-hari. Tapi pernahkah kalian membuat kue atau membeli kue ? kue yang di jual di toko-toko dapat bertahan beberapa lama karena ditambahkan pengawet yaitu natrium benzoat. Natrium benzoat adalah suatu senyawa kimia yang tergolong dalam senyawa yang memiliki ciri khas aromatik.
Atau contoh lain, pernahkah kamu mengalami salah urat atau keseleo, lalu apa yag kamu lakukan ? hal pertama yang kamu lakukan adalah mencari minyak gosok atau balsem gosok, lalu kamu menggosokan pada bagian yang terkena nyeri tersebut. Tahukah kamu bahwa pada balsem tersebut mengandung metil salisilat yang merupakan salah satu senyawa turunan benzena, oleh karena itu balsem gosok memiliki wangi yang khas karena mengandung senyawa benzena.
Benzena dan turunanya merupakan senyawa aromatik atau senyawa yang memiliki bau wangi yang khas, nama aromatik itu diberikan karena anggota-anggota yang pertama dikenal adalah yang berbau sedap. Semakin berkembangnya ilmu pengetahuan kini istilah aromatik itu pasti dikaitkan dengan suatu golongan senyawa dengan struktur dan sifat-sifat khas tertentu. Ilmuwan yang pertamakali menemukan senyawa benzena adalah ilmuwan Inggris Michael Faraday, Senyawa benzena diisolasi pertama kali pada tahun 1825, hasil penemuannya dari residu minyak yang tertimbun dalam pipa induk gas di London.
Struktur Benzena
Benzena merupakan hidrokarbon aromatik yang paling sederhanadengan rumus molekul C6H6, benzena terdiri atas satu cincin enam karbon dengan satu atom hidrogen terikat pada setiap karbon dan terdapat tiga buah ikatan rangkap karbon dengan karbon, sejauh ini struktur benzena dapat dinyatakan dengan dua cara yaitu struktur kekule dan struktur delokalisasi π.
Struktur Kakule
Nama struktur kekule pertama kali ditemukan pada tahun 1865 oleh ilmuwan yang bernama Kekule. Beliau menemukan bahwa ada 6 atom karbon yang tedapat di sudut-sudut heksagon beraturan, dengan satu atom hidrogen melekat pada setiap atom karbon. Menurut ilmuwan Kekule, dia menyatakan bahwasetiap atom karbon mempunyai 4 atom valensi maka harus terdapat ikatan tunggal dan ganda yang berseling di sekeliling cincin. Struktur benzena dengan rumus kakule dapat dituliskan sebgai berikut.
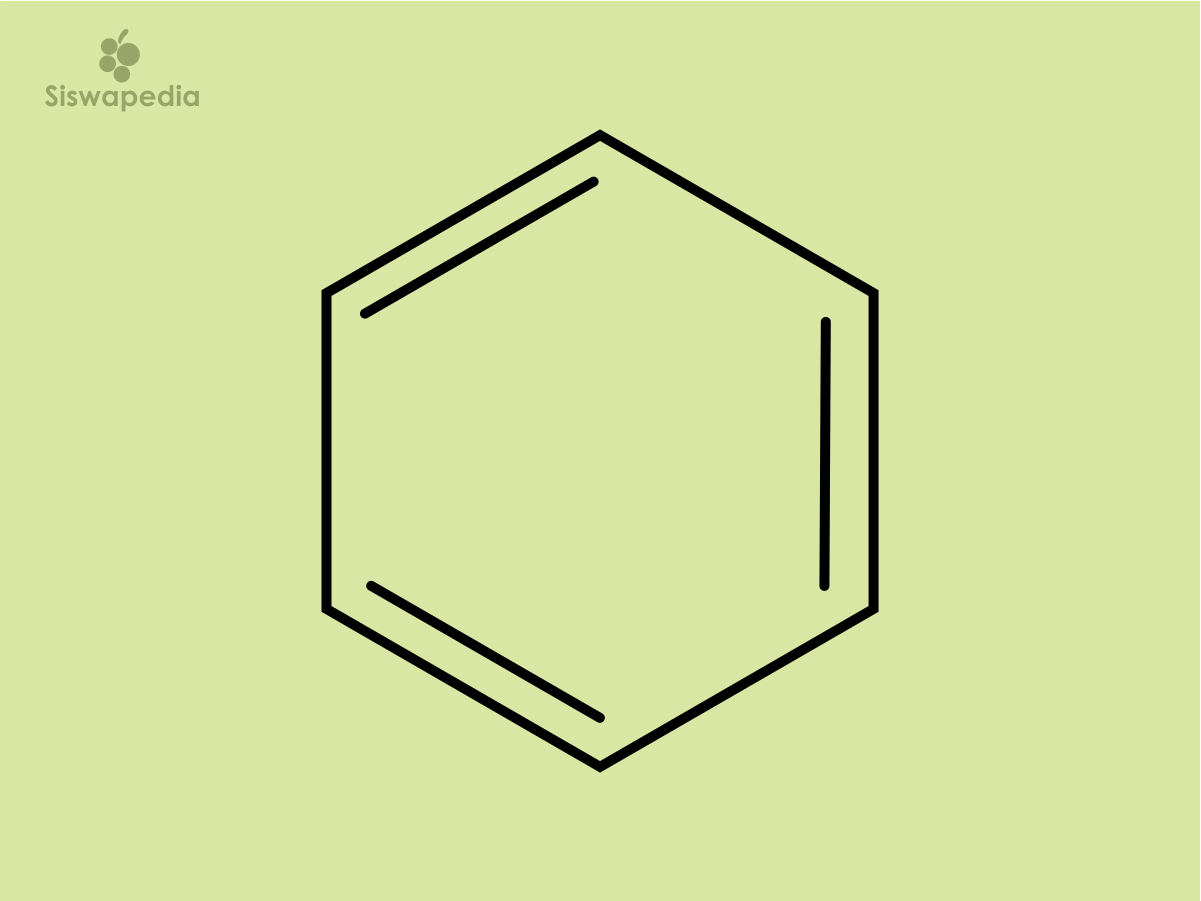
Struktur delokalisasi π
Struktur benzena sangat stabil karena elektron-elektron pada ikatan rangkap dalam senyawa benzena tersebar di seluruh cincin. Para ahli kimia kemudian menggambarkan kira-kira ukuran struktur benzena dengan merujuk pada sistem elektron π (pi) delokalisasi. Benzena biasanya digambarkan sebagai segi enam beraturan dengan lingkaran di dalam nya, seperti gambar di bawah ini.
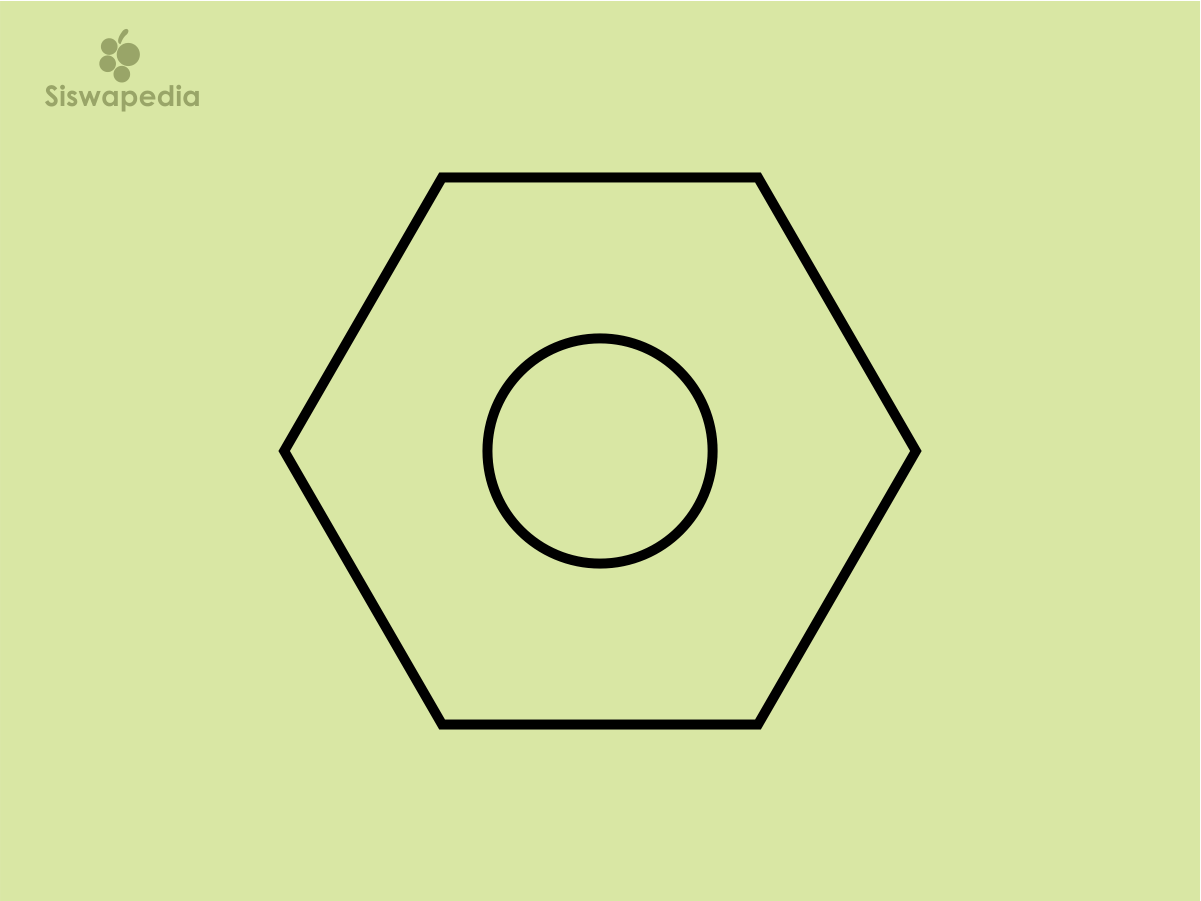
Pengukuiran spketroskopik menujukkan bahwa molekul benzena adalah bersifat planar dan semua ikatan karbon-karbon nya sama panjang yaitu sekitar 1,39 Ά. Ikatan karbon-karbon tunggal pada benzena panjangnya sekitar (1,47Ά) dan ikatan karbon-karbon rangkap (1,33Ά).
Ikatan rangkap karbon-karbon pada struktur benzena mengalami resonansi atau berpindah-pindah. Hal ini yang menyebabkan mengapa benzena sukar mengalami adisi. Ikatan-ikatan karbon pada senyawa benzena terdiri atas 2 ikatan yaitu ikatan sigma (σ) dan ikatan phi (π).
Pada teori ini ikatan valensi orbital molekul terbentuk dari tumpang tindih orbital-orbital atom. Ikatan kovalen yang terbentuk dari tumpang tindih ujung dengan ujung disebut ikatan sigma (σ), sedangkan ikatan phi (π) adalah ikatan kovalen yang terbentuk dari tumpang tindih sisi dengan sisi.
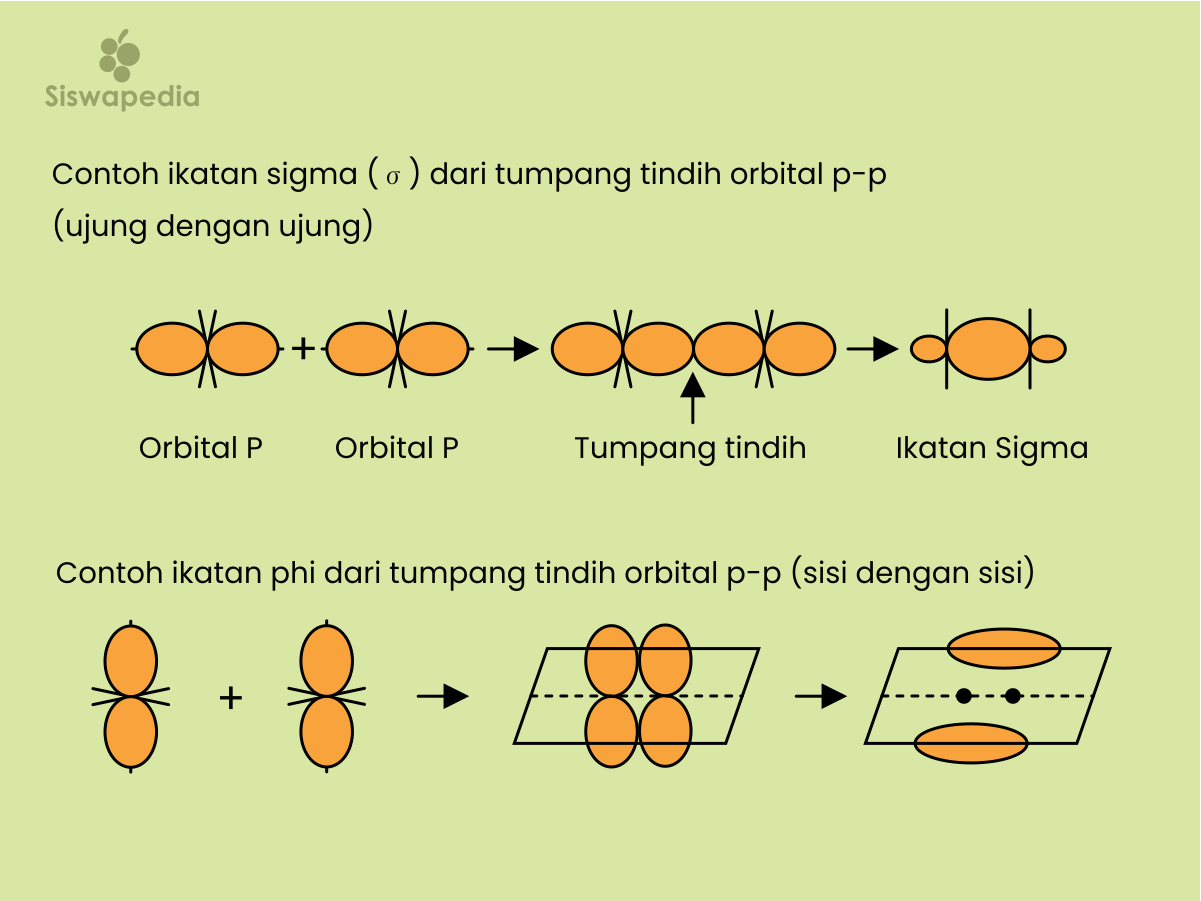
Ikatan sigma merupakan ikatan yang pertama antara dua atom, dan ikatan phi adalah ikatan yang ke dua antara atom. Jadi bisa di simpulkan ikatan tunggal adalah ikatan sigma, sedangkan ikatan kovalen rangkap dua terdiri atas ikatan sigma dan ikatan phi.
Benzena memiliki enam karbon sp2 sebagai ciri utama dalam sebuah ikatan cincin segi enam datar. Akibat dari adanya tumpang tindih ke enam pada orbital p mengakibatkan terbentuknya enam orbit molekul phi sehingga terbentuk awan elektron berbentuk bulat seperti donat pada bagian atas dan bawah cincin segi enam benzena.
Sifat-sifat Benzena
- Benzena merupakan zat yang berbentuk cairan kental seperti minyak, memiliki titik lebur sebesar 5,50C
- Benzena memiliki sifat yang kurang reaktif dibandingkan dengan alkena karena ikatan rangkap pada benzena dapat mengalami resonansi.
- Benzena dapat mengalami reaksi substitusi atau reaksi penggantian.
Baca juga: Protein
a. Subsitusi pertama
- Halogenasi
Senyawa benzena dapat bereaksi langsung dengan halogen dengan bantuan katalisator FeCl3 atau FeBr3.
- Alkilasi
Senyawa benzena dapat bereaksi dengan alkil halida membentuk alkil benzena dengan bantuan katalisator AlCl3.
- Nitrasi
Senyawa benzena dapat bereaski dengan asam nitrat pekat dengan katalisator asam sulfat pekat menghasilkan nitro benzena.
- Sulfonasi
Senyawa benzena yang dipanaskan dapat bereaksi dengan asam sulfat pekat menghasilkan asam benzena sulfonat.
b. Aromasitas molekul
Ada beberapa kriteria agar suatu molekut dapat bersifat aromatik seperti pada senyawa benzena:
- Struktur molekulnya harus siklik dan datar (hibridisasi sp2)
- Tiap atompada cincin harus memiliki orbital p tegak lurus pada bidang cincin.
- Memenuhi aturan Huckle, aturan ini menyatakan bahwa agar menjadi senyawa yang memiliki aromatik, suatu senyawa datar monosiklik (satu cincin) harus memiliki elektron π sebanyak 4n + 2 , dengan ketentuan n adalah bilangan bulat.
Contoh: apakah senyawa siklookta tetraena bersifat aromatik ?
Jawaban: Terlebih dahulu kita gambarkan rumus struktur siklookta tetraena.
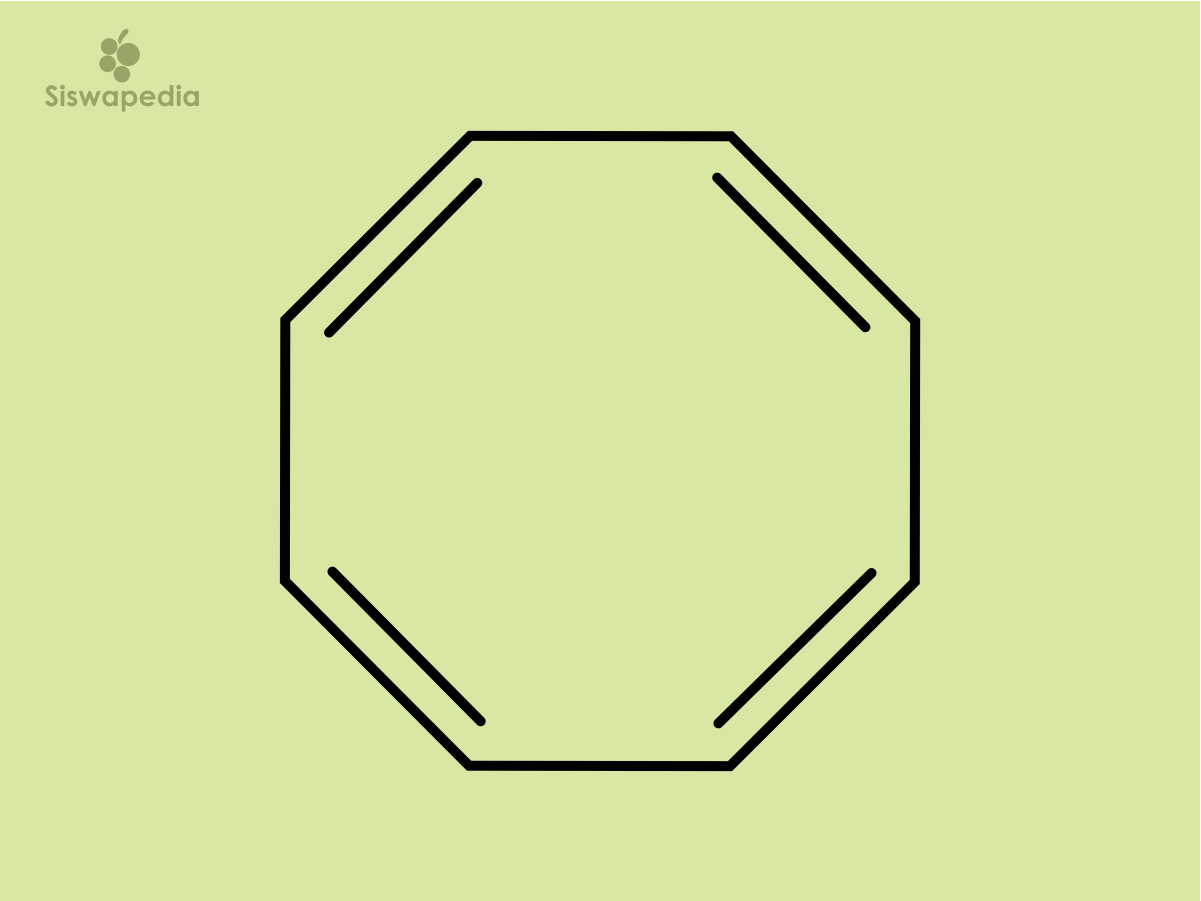
Berdasarkan dari rumus struktur di atas maka dapat kita lihat bahwa banyaknya elektron π = 8 yang tidak memenuhi 4n + 2 maka dapat disimpulkan bahwa siklookta tetraena tidak aromatik, hal ini disebabkan karena senyawa ini memiliki delapan orbital p pada cincin, sehingga tumpang tindih kedelapan orbital p tidak maksimum dan senyawa itu tidak menjadi senyawa yang aromatik (untuk mencapai stabilisasi aromatik tumpang tindih harus maksimum dan lengkap).
Pembuatan senyawa benzena
Senyawa benzena dapat dibuat dengan beberapa cara yaitu:
- Polimerisasi asetilena, pada proses ini dapat dilakukan dengan cara mengalirkan asetilena melalui pipa kaca yang pijar.
Di tulis dalam reaksi 3 C2H2 → C6H6
Baca juga: Polimer
- Dilakukan dengan cara memanaskan kalsiu benzoat dengan kalsium hidroksida, dengan reaksi berikut:
Ca (C6H5COO)2 + Ca (OH)2 → 2 C6H6 + 2CaCO3
- Dilakukan dengan cara destilasi tir batu bara.
Pada destilasi bertingkat tir batu bara selain dihasilkan benzena juga diperoleh zat-zat yang lain, misalnya tokrena, xilena, naftalena, antrosena, fenatrena, fenol, dan kreson.
- Dengan proses reforming nafta pada industri petrokimia.
Baca juga: Perbedaan lemak dan minyak
Kegunaan Bezena
Senyawa benzena banyak digunakan terutama sebagai bahan dasar dalam pembuatan senyawa-senyawa turunannya, seperti stirena dan sikloheksana biasanya pembuatan senyawa turunan benzena ini terdapat pada industri petrokimia. Fungsi lain dari benzena adalah digunakan sebagai bahan dasar dalam pembuatan detergen, bahan bakar dan sebagai pelarut dalam jumlah yang sedikit.
Demikian pembahasan kita pada materi Contoh, Sifat dan Kegunaan Benzena ini, semoga tulisan ini bisa memberi manfaat untuk teman-teman, adik- adik atau yang lainya. Apabila ada yang tidak kalian pahami atau ingin bertanya lebih lanjut bisa isi dolom komentar, terimakasih.
Daftar Pustaka:
Sukmawati Wening. (2009). Kimia Untuk SMA Dan Ma Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Utami Budi, dkk. (2009). Kimia Untuk SMA/MA Kelas XII Program Ilmu Alam. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.
Pangajuanto Teguh dan Harmidi Tri. (2009). Kimia 3 Untuk SMA/MA Kelas XII. Pusat Perbukuan Departemen Pendidikan Nasional. Jakarta.





